
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________。
(3)O3的空间构型为__________________;分子中存在大π键,可用符号Π![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、__________________________(任写两种即可)。
(5)已知:表格中键能和键长数目。
化学键 | 键长/pm | 键能/(kJ·mol-1) |
N-N | 145 | 193 |
N=N | 125 | 418 |
N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________。
(6)Na2O的晶胞结构如图所示 ,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
【答案】4 > 失去一个电子后O+的2p处于半充满状态,更加稳定,再失去一个电子消耗能量更高 V形 极性 ![]() H3N…H-O、H2O…H-N、H2O…H-O(任写两种) N4中N-N键键能小于N2中的N≡N键键能,键长大于N≡N键键长 8
H3N…H-O、H2O…H-N、H2O…H-O(任写两种) N4中N-N键键能小于N2中的N≡N键键能,键长大于N≡N键键长 8 ![]() ×100%
×100%
【解析】
(1)O位于周期表中第2周期第ⅥA族;
(2)根据轨道中电子处于全满、全空、半满时较稳定,再失去电子需要的能量较大来分析;
(3)中心为O,根据VSEPR理论判断空间构型,分子中正负电荷中心重合为非极性分子,不重合为极性分子,根据O的分子结构分子其离域大π键构型;
(4)NH3和H2O可以形成分子间氢键,N和O的电负性较大,可以形成分子间氢键,增大溶解度;
(5)根据键能大小分析分子的稳定性;
(6)根据晶胞结构图分析,O2-做面心立方最密堆积,Na+做四面体填隙,从上底面面心的O2-分析其配位数,晶胞的空间利用率为V球/V晶胞×100%。
(1)O位于周期表中第2周期第ⅥA族,则O原子中价电子排布式为2s22p4,占据4个轨道;
(2)N价层为2s22p3,O价层为2s22p4,N的2p能级为半满结构,比较稳定,则第一电离能I1:N>O;N和O均失去一个电子后,N价层为2s22p2,O价层为2s22p3,O+的2p能级半满,比较稳定,所以第二电离能I2:N<O;原因是:失去一个电子后O+的2p处于半充满状态,更加稳定,再失去一个电子消耗能量更高;
(3)中心为O,根据VSEPR理论,价电子对数为VP=BP+LP=2+(6-2×2)/2=3,VSEPR模型为平面三角形,由于一对孤电子对占据平面三角形的一端,所以其空间构型为V形;分子中正负电荷中心不重合,为极性分子;分子中存在的大π键,中心O为sp2杂化,2s、两个2p发生杂化,剩余一个p轨道留有一对电子,端位O原子的各取一个带有单电子的p轨道形成3中心4电子的离域大π键,记为![]() ;
;
(4)NH3和H2O可以形成分子间氢键,N和O的电负性较大,可以形成分子间氢键,增大溶解度,形成的氢键可以为:H3N…H-O,H2O…H-N(或H2O…H-O),故答案为:H3N…H-O;H2O…H-N(或H2O…H-O);
(5)根据键能大小,N4中N-N键能小于N2中的N≡N,键长大于N≡N,键能越小,分子越活泼,越不稳定;
(6)根据晶胞结构图分析,O2-做面心立方最密堆积,Na+做四面体填隙,从上底面面心的O2-分析,周围等距且最近的Na+有8个,所以O2-的配位数为8,一个晶胞中含有O2-的数目为8×1/8+6×1/2=4个,含有Na+的数目为8个,所以一个晶胞中V球=4×![]() πr3(O2-)+8×
πr3(O2-)+8×![]() πr3(Na+)=
πr3(Na+)=![]() πy3+
πy3+![]() πx3,晶胞的棱长为a,所以晶胞体积为V晶胞=a3,所以晶胞的空间利用率为
πx3,晶胞的棱长为a,所以晶胞体积为V晶胞=a3,所以晶胞的空间利用率为![]() ×100%=
×100%=![]() ×100%。
×100%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是_______________________ 。
(2)A的化学式为_____________________,D的化学式为_____________________,D溶液显碱性的原因是(用离子方程式表示):__________________________。
(3)E和氨水反应的离子方程式是________________________________。E与D反应的离子方程式是__________。
(4)设计实验检验B中所含的阳离子:_____________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,苯与氯气在氯化铁催化下连续反应,生成以氯苯、氯化氢为主要产物,邻二氯苯、对二氯苯为次要产物的粗氯代苯混合物。有关物质的沸点、熔点如图,下列说法不正确的是( )
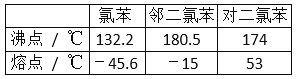
A. 该反应属于取代反应
B. 反应放出的氯化氢可以用水吸收
C. 用蒸馏的方法可将邻二氯苯从有机混合物中首先分离出来
D. 从上述两种二氯苯混合物中,用冷却结晶的方法可将对二氯苯分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是
等。下列说法正确的是
A. ![]() 和
和![]() 的化学性质完全不同
的化学性质完全不同
B. 元素Ts的相对原子质量为![]()
C. 基态![]() 原子核外电子共占据7个能级
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:


(1)此“84消毒液”的物质的量浓度约为________。(计算结果保留一位小数)
(2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=___mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是________________(填仪器序号),还缺少的玻璃仪器是______________。
②该同学配制此溶液需称取称量NaClO固体的质量为_________________g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是____________(填序号)。
a.定容时俯视刻度线 b.转移前,容量瓶内有蒸馏水
c.未冷至室温就转移定容 d.定容时水多加了,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
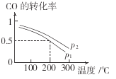
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
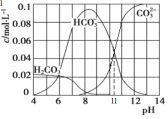
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是 ( )
A. 升高温度水的离子积增大
B. 镁条与氯化铵溶液反应生成氢气
C. 碳酸钙与稀盐酸反应生成二氧化碳
D. 加入少量硫酸铜可增大锌与稀硫酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
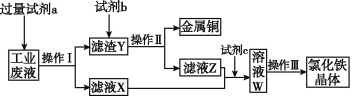
则下列说法正确的是
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com