
【题目】下列离子方程式正确的是
A.碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.海带灰浸泡滤液中加入稀硫酸后再加入双氧水:2I-+ H2O2+4H+ = I2+2H2O
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.1L4mol·L-1 NaOH溶液中通入67.2LCO2(标准状况下),反应的离子方程式为:4OH- +3CO2 = 2HCO3-+CO32-+H2O
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,
试回答下列问题:
(1)写出滴定实验中所发生反应的离子方程式:_________________________________________________________
(2)实验中KMnO4溶液应装在___________式滴定管中,滴定终点的判断依据是_______________________________
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1
(4)若滴定终点读数时目光俯视,则计算出的x值可能_______________(填“偏大”、“偏小”、“无影响”)
(5)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是
等。下列说法正确的是
A. ![]() 和
和![]() 的化学性质完全不同
的化学性质完全不同
B. 元素Ts的相对原子质量为![]()
C. 基态![]() 原子核外电子共占据7个能级
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
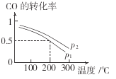
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
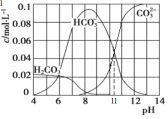
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是 ( )
A. 升高温度水的离子积增大
B. 镁条与氯化铵溶液反应生成氢气
C. 碳酸钙与稀盐酸反应生成二氧化碳
D. 加入少量硫酸铜可增大锌与稀硫酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
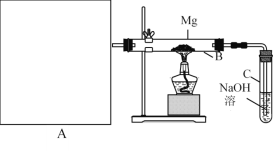
Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 时
时
化学式 |
|
|
|
电离平衡常数 |
|
|
|
下列说法正确的是 ( )
A. 醋酸稀释过程中,![]() 逐渐减小
逐渐减小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均产生
,均产生![]()
D. 物质的量浓度相同时![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A._______;B.______;C.______;
D._______;E.______;F._______。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
E![]() B:______
B:______
C![]() F:______
F:______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com