
【题目】氨溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述中正确的是 ( )
A.“两水”都是混合物,溶液中含有的粒子种类数目相同
B.“两水”中都存在可逆反应
C.“两水”都有刺激性气味,都能漂白有机色素
D.“两水”放置时间较久后都会因为相同的原理而变质
科目:高中化学 来源: 题型:
【题目】过氧化钠与二氧化氮能发生反应,某兴趣小组对此进行探究,提出了两种假设。
假设一:Na2O2+2NO2===2NaNO2+O2↑
假设二:Na2O2+2NO2===2NaNO3
[查阅资料]
2NaNO2+2HCl===2NaCl+NO↑+NO2↑+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
[实验探究]
Ⅰ.按图示装置进行实验。
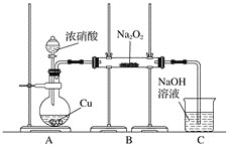
Ⅱ.通入二氧化氮至过氧化钠反应完全,然后对玻璃管中的固体物质进行检验。
[实验结论] 实验表明,过氧化钠与二氧化氮按“假设二”反应。
(1)过氧化钠与二氧化氮的反应中,氧化剂是____。
(2)装置A中反应的离子方程式是________。
(3)装置C的作用是__________。
(4)请设计实验证明装置B中的反应不符合“假设一”。
①实验操作:取玻璃管中的固体置于试管中,________;
②实验现象是________。
(5)有同学认为:只要直接观察C中导管口是否有气泡冒出,就可以判断B中的反应符合哪一种假设,这种想法________(填“对”或“不对”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面物质间转换的框图,回答有关问题:
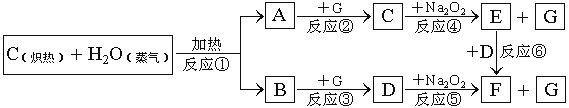
(1)写出框图中物质A、B、E、F分别指代物质的化学式:A._____________ B._____________ E._____________ F.______________
(2)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积_________L;同时反应中转移电子总数是____________。(NA表示阿伏加德罗常数)
(3)如果A、B混合气体3.0g(平均摩尔质量15g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重__________g,并得到O2_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向苯酚钠溶液中通入少量CO2:2C6H5O![]() +CO2+H2O→2C6H5OH+CO32-
+CO2+H2O→2C6H5OH+CO32-
B. NH4HSO3溶液与足量NaOH溶液反应:HSO![]() +OH-=SO32-+H2O
+OH-=SO32-+H2O
C. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
D. H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO![]() +6H+= 518O2+2Mn2++8H2O
+6H+= 518O2+2Mn2++8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两种常见金属A(地壳中含量第二的金属)、B(红色金属)分别与两种酸X、Y发生反应,其转化关系如图所示,其中D为红棕色气体。
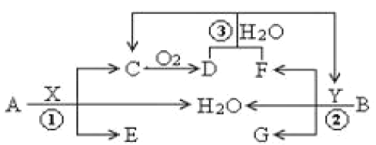
回答以下问题:
(1)反应③的离子反应方程式为___;
(2)6.4gB与过量X溶液(8mol /L、60mL)充分反应后,生成的还原产物有C、D,反应后溶液中所含X为n mol ,此时溶液中所含X的阴离子的物质的量为___mol。
(3)常温下A与Y的稀溶液能发生反应生成盐W,关于固体W的转化关系如图所示(无关物质已略去)。其中N是红棕色的化合物。
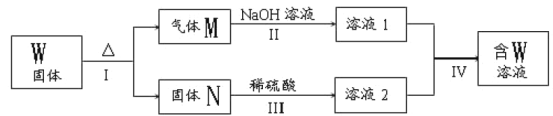
①M由两种化合物组成,其中含有F;将M通入BaCl2溶液,实验现象是___。
②若经反应I得到16 g固体N,产生的气体M恰好被0.3L1mol·L-1 NaOH溶液完全吸收得溶液1,则反应Ⅳ中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基二茂铁常用作火箭燃料添加剂、汽油抗爆剂等。某兴趣小组制备乙酰基二茂铁,流程如下:

已知:
a.反应原理:![]() +(CH3CO)2O
+(CH3CO)2O![]() CH3COOH+
CH3COOH+
b.二茂铁熔点173℃,沸点249℃,100℃易升华。
c.乙酰基二茂铁熔点81℃,沸点163℃。不溶于水,易溶于有机溶剂。
请回答:
(1)步骤I,在50 mL圆底烧瓶中,加入新制的、经提纯后0.5 g二茂铁,5 mL乙酸酐,在振摇下滴入1 mL 85%磷酸,提纯二茂铁的方法为_______________。
(2)步骤II,加料毕,用装填有CaCl2的干燥管塞住圆底烧瓶瓶口。如图所示,其目的是__________。

(3)步骤IV,反应完毕后,将紫色混合物倾入含40 g碎冰烧杯中,并用10 mL冷水洗涤烧瓶,将洗涤液并入烧杯,在搅拌下加入NaHCO3(s),判断溶液呈中性的实验方法为__________。
(4)步骤V,包括结晶、吸滤、洗涤、干燥等多步操作。下列说法正确的是__________。
A.为较快地析出晶体,可以用玻璃棒摩擦烧杯内壁
B.吸滤装置由吸滤瓶、布氏漏斗、抽气泵组成
C.宜用乙醇洗涤,洗涤后乙醇易挥发
D.可在100℃红外灯下干燥
(5)①粗产品中含有杂质为___________,可以用来鉴别的仪器是___________。
②分离提纯粗产品后,用薄层层析来测定Rf值。选出其正确操作并按序列出字母:a→c→_______→_______→________→_________→g。
a.制备薄层色谱板
b.用少量纯二茂铁和提纯后的产品分别溶于2 mL甲苯中,配成浓溶液
c.用细玻璃管拉制两根微量滴管(尖端处约0.7mm)
d.将色谱板插入盛有乙醚的槽内,盖上盖子
e.待溶剂上升到色谱板3/4高度时,取出色谱板,并标记溶剂所到高度
f.分别用微量滴管浸入两浓溶液,在色谱板两原点处点样,待干燥后,再重复点样
g.计算Rf值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:
(1)硅有非常重要的用途,请写出其中的一种:_________________________________。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是________。
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
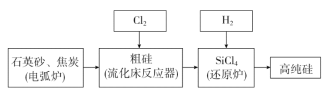
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式:________________。
②SiCl4极易水解,在空气中生成烟尘和白雾,推测书写其水解的化学方程式为____________________。
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g);ΔH=-90.8kJ/mol。
CH3OH(g);ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=____,如升高温度,K值将______(填:增大、减小或不变)。
(2)以下各项能说明该反应达到平衡状态的是____________.
A.混合气体的密度保持不变 B.甲醇的质量分数保持不变
C.CO的浓度保持不变 D.2v逆(H2)=v正(CH3OH)
(3)在210°C、240°C和270°C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
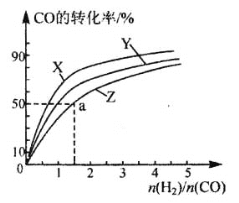
如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_____。由起始达到a点所需时间为5min,则H2的反应速率为:_______________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
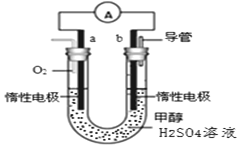
①该电池工作时,正极是____________极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com