
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
【答案】①⑤ ②③ ⑧ ②⑦ ④⑥ ④>②>③>⑤>① 金属晶体 分子晶体 离子晶体 原子晶体 氯化铯 氯化钠 二氧化硅 金刚石(或晶体硅)
【解析】
(1)根据组成元素及微粒之间的化学键分析;根据晶体的熔点:原子晶体>离子晶体>金属晶体>分子晶体;
(2)根据晶体的物理性质分析晶体类型;
(3)根据晶体结构模型判断物质的种类。
(1) ①CO2⑤CS2中只含有极性键,分子都是直线形分子,正负电荷中心重合,属于非极性分子;由极性键形成的非极性分子有①⑤;
②NaCl是由钠离子和氯离子构成;③Na是由钠离子和自由电子构成,都含有金属离子;含有金属离子的物质是②③;
⑧乙醇中羟基氢与羟基上的氧原子能形成氢键;分子间可形成氢键的物质是⑧;
②NaCl由钠离子和氯离子构成,属于离子化合物;⑦(NH4)2SO4由铵根离子和硫酸根离子构成,属于离子化合物;离子化合物在固态时均为离子晶体;属于离子晶体的是②⑦;
④Si⑥金刚石都是由原子构成的原子晶体;属于原子晶体的是④⑥;
晶体的熔点:原子晶体>离子晶体>金属晶体>分子晶体,Si和金刚石都是原子晶体,原子半径越小,共价键越强,熔点越高,CO2和CS2都是分子晶体,相对分子质量越大熔点越高,Na的熔点低于100℃,,所以熔点高到低的顺序为: ④>②>③>⑤>①;
综上所述,本题答案是: ①⑤; ②③; ⑧; ②⑦; ④⑥; ④>②>③>⑤>①。
(2)A.固态时能导电,能溶于盐酸,属于活泼金属,属于金属晶体;
B.能溶于CS2,不溶于水,属于分子晶体;
C.固态时不导电,液态时能导电,可溶于水,属于离子晶体;
D.固态、液态时均不导电,熔点为3500 ℃,属于原子晶体;
综上所述,本题答案是:金属晶体,分子晶体,离子晶体,原子晶体。
(3)由晶胞结构模型可知:在氯化铯晶体中,每个Cs+同时吸引8个Cl-,每个Cl-吸引8个Cs+,而氯离子与铯离子数目之比为1:1,故A为氯化铯;
在氯化钠晶体中,每个Na+同时吸引着6个Cl-,每个Cl-吸引着6个Na+,而氯离子与钠离子的数目之比为1:1,故B为氯化钠晶体;
在二氧化硅晶体中,每个Si原子与4个O原子结合,每个O原子与2个Si原子,硅原子与氧原子的个数比为1:2,故C为SiO2;
在金刚石晶体中,每个碳原子周围紧邻4个碳原子,最小碳环由6个碳原子组成,故D为金刚石;(晶体硅的结构和金刚石相似)。
由晶胞结构模型可以知道A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石(或晶体硅);
综上所述,本题答案是:氯化铯,氯化钠,二氧化硅,金刚石(或晶体硅)。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】(加试题)
(一)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
CH2=CH2(g)+CH3COOH(1)![]() CH3COOC2H5(1)
CH3COOC2H5(1)
(1)下列描述能说明固定容器中乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是___________。
A.乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.体系中气体密度一定
D.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
(2)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
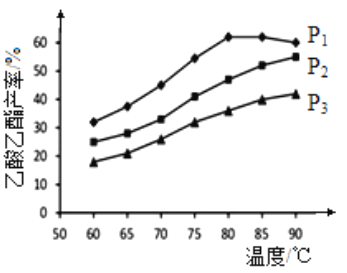
①温度在60~90℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是___________[用v(P1)、v(P2)、v(P3)分别表示不同压强下的反应速率],分析其原因为______________________。
②在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是______________________。
③根据测定实验结果分析,较适宜的生产条件是______________________(填出合适的压强和温度)。为提高乙酸乙酯的产量和纯度,可以采取的措施有______________________(任写出一条)。
(3)已知反应③的标准平衡常数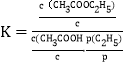 ,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在80℃和10MPa下反应,乙酸乙酯的平衡产率为80%,则KΘ=__________。
,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在80℃和10MPa下反应,乙酸乙酯的平衡产率为80%,则KΘ=__________。
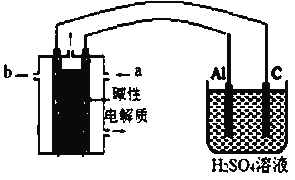
(二)某化学兴趣小组在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。可供选择的试剂有:甲醇,空气,KOH溶液,其中物质b是__________,铝电极的电极反应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:

(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠中混有硫酸镁、硫酸钙、氯化镁杂质,除去杂质,加入的试剂顺序为( )
①![]() 、NaOH、
、NaOH、![]() 、HCl ②
、HCl ②![]() 、HCl、
、HCl、![]() 、NaOH
、NaOH
③NaOH、![]() 、
、![]() 、HCl ④
、HCl ④![]() 、
、![]() 、NaOH、HCl
、NaOH、HCl
A.①③B.①④C.②④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. CHCl3+HF → CHFCl2+HCl 属于取代反应
B. 煤气化生成 CO 和H2,再经过催化合成可以得到甲醇等液体燃料
C. 石油裂解气和SO2 都能使 KMnO4 溶液褪色,褪色原理不同
D. 苯在一定条件下能与H2 发生加成反应,也能与氯气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )

A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种微粒的结构示意如下,下列说法错误的是( )
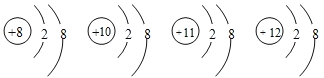
A.它们属于不同种元素
B.它们的核外电子排布相同
C.它们都是离子
D.它们都具有稀有气体原子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在人类的生活生产中有着重要的作用,Fe2+、Fe3+是影响水质的一个重要因素。回答下列问题:
I:测量某河水样本中铁的含量
(1)水样中Fe2+的含量越大,溶解氧的含量就越低,用离子方程式解释原因___________。
(2)测定Fe2+取5mL c mo/L的KMnO4标准液,稀释至100mL。取10.00mL河水水样,加入稀硫酸后,用稀释后的KMnO4溶液进行滴定,用去KMnO4溶液V1mL。
①用___________(填滴定管的名称)盛放KMnO4标准液。
②滴定达到终点的标志是___________。
(3)测定Fe3+:取10.00mL水样,转移至盛有过量锌粒的烧杯中充分反应。加入过量稀硫酸,用表面皿盖住烧杯并加热10分钟。冷却后用(2)中稀释后的KMnO4溶液滴定,消耗KMnO4溶液V2mL。
①锌粒的作用是___________。
②河水中Fe3+的浓度是___________mol/L(用含字母的代数式表示)。
Ⅱ:氢氧化亚铁[Fe(OH)2]在常温常压下为白色固体。
(4)当溶液中的离子浓度<1×10-5mol·L-1时,可以认为该离子已沉淀完全。已知常温Fe(OH)2的Ksp为8.0×10-16。现调节含Fe2+的某河水样品pH=9,用简要计算过程说明Fe2+是否已经达到沉淀完全:___________。
(5)一种用Na2SO4溶液做电解液,电解制取Fe(OH)2的实验装置如图所示。通电后,溶液中产生白色沉淀,且较长时间不变色。

①必须使用铁电极的是___________(填“A"或“B”)极。
②B电极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com