
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HB物质的量浓度(mol/L) | KOH物质的量浓度(mol/L) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c1 | 0.2 | pH=7 |
丙 | 0.1 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L________?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HB是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算),c(K+)-c(B-)=_mol/L。
(1)若a=7,则HB为强酸,若a>7,则为弱酸
(2)否;C (3)弱;c(Na+)>c(B-)>c(OH-)>c(H+)
(4)10-5;10-5-10-9
【解析】(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生成的产物是KB,对KB溶液分析,若a=7,说明HB是强酸,若a>7,说明溶液因B-的水解而显碱性,则HB是弱酸。(2)c1不一定等于0.2。当HB是强酸时等于0.2;当HB是弱酸时,大于0.2。因为pH=7,说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(K+)=c(B-)。(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7。说明B-水解,得到HB是弱酸,其他易推知。(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9mol/L,则由水电离产生的c(H+)=c(OH-)=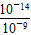 =10-5(mol/L),由电荷守恒得:c(K+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=(10-5-10-9)mol/L。
=10-5(mol/L),由电荷守恒得:c(K+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=(10-5-10-9)mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
合成结构简式为 的高聚物,其单体应是:①苯乙烯;②丙烯;③2?丁烯;④1?丁烯;⑤乙烯;⑥苯丙烯( )
的高聚物,其单体应是:①苯乙烯;②丙烯;③2?丁烯;④1?丁烯;⑤乙烯;⑥苯丙烯( )
A.①②③ B.①④⑤ C.③⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的 Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
25℃时,某浓度的氯化铵溶液的pH=4,下列叙述中不正确的是( )
A.溶液中的c(OH-)=1×10-10 mol·L-1
B.溶液中的c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.溶液中的c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.溶液中的c(NH3·H2O)=c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
A.c(CO32—)的大小关系为:②>⑤>③>④>①
B.c(HCO3—)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入NH4Cl固体 ⑤向水中加入NaHCO3固体 ⑥向水中加入NaHSO4固体
A.①②⑤ B.①④ C.③④⑥ D.④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
25℃时,水中存在电离平衡:H2O H++OH-。下列关于水的说法,不正确的是 ( )
H++OH-。下列关于水的说法,不正确的是 ( )
A.水的电离是吸热过程
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.含H+的溶液显酸性,含OH-的溶液显碱性
D.水是极弱的电解质,在50℃时水的pH小于7
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
在一密闭恒容的容器中,可逆反应3A(g) 3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
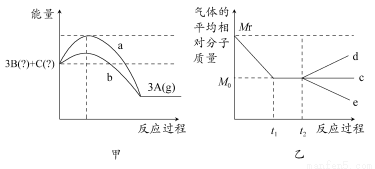
(1)由图甲可以判断3A(g) 3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
(2)由图乙可以得出有关B和C状态的结论是________。
①若t2时刻升高温度,气体的平均相对分子质量变化一定符合________线(填“c”“d”或“e”)。
②若改变压强,气体的平均相对分子质量变化一定符合c线,则C物质的状态为________。
(3)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是________状态,C是________状态。
(4)如果B为气体,C为固体,取0.3 mol A恒温下在1 L容器中充分反应,平衡时测得B的浓度为0.21 mol/L。若使反应从逆反应开始,起始时在容器中加入0.3 mol B,同样条件下,要使平衡时B的浓度仍为0.21 mol/L,则C的物质的量的取值范围应该是________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
下列说法不正确的是( )
①0.1 mol·L-1盐酸和0.1 mol·L-1醋酸分别与0.2 mol·L-1氢氧化钠溶液反应的速率相同
②0.1 mol·L-1盐酸和0.1 mol·L-1硝酸分别与大小相同的大理石反应的速率不同
③大理石块与大理石粉末分别与0.1 mol·L-1盐酸反应的速率不同
④已知t℃时反应N2(g)+3H2(g) 2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大
2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大
⑤合成氨中及时分离出氨气后可减小反应速率
⑥在合成氨反应中,相同条件下在有催化剂时(a)和无催化剂时(b)速率时间图像可用下图一表示
⑦在合成氨反应中,不同温度下(T2>T1)的NH3的体积分数与时间的关系图像可用图二表示
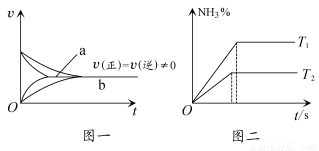
A.除①⑦外 B.除③⑤⑥外 C.除③⑤外 D.除③⑥⑦外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com