
判断存放的FeCl2溶液是否变质。从现象观察看 ;鉴定的方法为加入 试剂,若溶液出现 ;则证明有 存在。实验室为了防止FeCl2溶液变质,在配制时常加入 。向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象 。
科目:高中化学 来源: 题型:
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题。
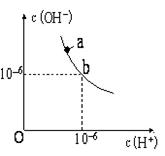
(1)如下图,某温度(t℃)时水的图像如下,a点离子积KW= mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显 性。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH ,NH4+的物质的量浓度 。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),则混合前c(NaOH)
c(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶浸过程中会发生反应:
CaSO4(s)+CO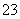 (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO (aq)。
(aq)。
已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为 (计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①原溶液中Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A.①②③ B.②③④
C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
元素Cu的一种氯化物晶体的晶胞结构如图所示,计算推出该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述中,属于烷烃特征的是 ( )
A、完全燃烧产物只有二氧化碳和水 B、几乎不溶于水
C、分子的通式为CnH2n+2,与氯气发生取代反应 D、它们是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com