
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�����������Һʱ��ѡ�������ָʾ��������д���пհף�
��1���ñ���������Һ�ζ����������������Һʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��__________��ֱ���������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����___________Ϊֹ��
��2�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������������Һ�����Ϊ_________mL��

��3�����в����п���ʹ��������������Һ��Ũ����ֵƫ�͵���______________
��A����ʽ�ζ���δ�ñ�������Һ��ϴ��ֱ��ע���������Һ
��B���ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и���
��C����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��D����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
��4��ijѧ����������ʵ��ֱ��¼�й��������±�����ѡ�����к�����������ʽ���������������Һ�����ʵ���Ũ�ȣ�c(NaOH��=_________����ʽ��������������С�����4λ����

���𰸡�
��1����ƿ����Һ��ɫ�仯��������ڲ��ָ�ԭɫ
��2��26.10
��3��C
��4��0.1044mol/L
��������
���������
��1���۾��۲������ƿ��ָʾ����ɫ�ı仯�������ǵζ�����Һ�������仯���жϵζ��յ�ʱ��ע����ָʾ����ɫ�����仯������ڲ��ٸ�ԭ��
��2����ʼ����Ϊ0.00mL���յ����Ϊ26.10mL��������Һ�����Ϊ26.10mL��
��3��A�����δ�ñ�Һ��ϴ��������������������ʵ����Ҫ�ʲⶨ������������Һ��Ũ��ƫ�ߡ�B���Ӱ�죻C������������¶�����ʵ����ƫС����ʹ�ⶨ������������Һ��Ũ��ƫ�ͣ�D�����Ӱ��ֱ�ӵ��¶�����ʵ��ֵƫ��ʹ�ⶨ������������Һ��Ũ��ƫ�ߣ���ѡC��
��4��28.74Ӧ��ȥ����ȡ��һ���������������ƽ��ֵ��V=(26.11+26.09��/2= 26.10(mL������Ũ��Ϊ0.100 0 mol/L����������������Һ�����Ϊ25.00 mL����������ֵ���빫ʽ����⣬�������������Һ�����ʵ���Ũ��c(NaOH��=c(��������V(������ /V(NaOH��=0.1044 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ�����
���� ѡ�� | ������ | �� | ���� ������ | ���� ������ |
A | ��ʯ�� | �ռ� | ������ | ������̼ |
B | NH3��H2O | С�մ� | ����þ | �������� |
C | ��ˮ����ͭ | ���� | ������ | �������� |
D | H2O2 | �մ� | �������� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij��ѧ��Ӧ��������ʱ��Ĺ�ϵʾ��ͼ����t1ʱ�������¶Ȼ�������ѹǿ�����ʵı仯 �����ϵ�ʾ��ͼ�ķ�Ӧ�� �� ��
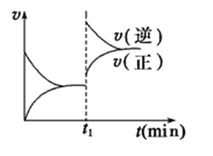
A. 2SO2(g)+O2(g)![]() 2SO3(g)����H��0
2SO3(g)����H��0
B. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)����H��0
4NO(g)+6H2O(g)����H��0
C. H2(g)+I2(g)![]() 2HI(g)����H��0
2HI(g)����H��0
D. N2(g)+3H2(g)![]() 2NH3(g)��H��0
2NH3(g)��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Li-SOCl2��ؿ����������������õ�صĵ缫���Ϸֱ�Ϊ﮺�̼�����Һ��LiAlCl4-SOCl2����ص��ܷ�Ӧ�ɱ�ʾΪ4Li+2SOCl2![]() 4LiCl+S+SO2����
4LiCl+S+SO2����
��ش��������⣺
(1)��صĸ�������Ϊ �������ĵ缫��ӦΪ ��
(2)������������ĵ缫��ӦΪ ��
(3)SOCl2�ӷ���ʵ�����г���NaOH��Һ����SOCl2����Na2SO3��NaCl���ɡ����������ˮ�ε�SOCl2�У�ʵ�������� ����Ӧ�Ļ�ѧ����ʽΪ ��
(4)��װ�õ�ر�������ˮ�������������½��У�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ͨ©����������ƿ����������ƿ������ƽ���ݷ�Һ©�����ζ��ܣ���ȼ�ճס����������ʷ������
A. �٢ۢ� B. �٢ڢ� C. �٢ۢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������6.02��1023��Oԭ�ӵ�H3PO4�����ʵ����ǣ� ��
A��1 mol B��0.5 mot C��0.25 mol D��0.125 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�ã��г���������ȥ��̽��ͭ˿�����Ũ����ķ�Ӧ������ʵ�鲻��������
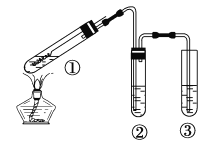
A. �����ƶ�����ͭ˿�ɿ���SO2�IJ�����ֹͣ
B. ����ѡ��Ʒ����Һ��֤SO2������
C. ����ѡ��NaOH��Һ���ն����SO2
D. Ϊȷ����CuSO4���ɣ�����м�ˮ���۲���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ϳɳ���أ��ܳ�ʱ�䱣���ȶ��ķŵ��ѹ���õ�ص��ܷ�ӦʽΪ3Zn��2K2FeO4
��8H2O![]() 3Zn(OH)2��2Fe(OH)3��4KOH������˵������ȷ����( )
3Zn(OH)2��2Fe(OH)3��4KOH������˵������ȷ����( )
A���ŵ�ʱ������ӦʽΪZn��2e����2OH��===Zn(OH)2
B���ŵ�ʱ������ӦʽΪFeO42����4H2O��3e��===Fe(OH)3��5OH��
C���ŵ�ʱÿת��3 mol���ӣ�������1 mol K2FeO4������
D�����ʱ������������Һ�ļ��Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ���ҵ�β���к��н϶���������ж���Ҫ������Щβ���������Լ����ʺϵ��ǣ� ��
A.����ˮ
B.����ʳ��ˮ
C.����ʯ��ˮ
D.�ռ���Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com