


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛋白质在腐败时,常会产生氨气,写出氨气的电子式
蛋白质在腐败时,常会产生氨气,写出氨气的电子式查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题:
如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:
为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
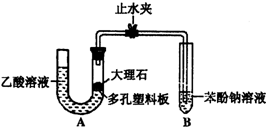 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g金属钠变成钠离子时失去的电子数目为0.2NA |
| B、通常状况下,22.4L氢气中所含分子数目为NA |
| C、1molNH3中所含的电子数为10NA |
| D、1 mol/L的NaCl溶液中含NA个钠离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,这是人类迄今发现的最重的星际分子.下列有关该分子的说法,正确的是( )
,这是人类迄今发现的最重的星际分子.下列有关该分子的说法,正确的是( )| A、属于不饱和链烃 |
| B、该分子中所有原子都满足8电子结构 |
| C、1mol该分子在一定条件下可与10molH2发生加成反应 |
| D、该分子可以由乙炔和含氮化合物加聚而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a=b且pH(NaX)>pH(NaY),则酸性HX>HY |
| B、若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY |
| C、若a>b且c(X-)=c(Y-),则酸性HX>HY |
| D、若a=0.1 mol/L且两溶液等体积混合,则c(X-)+c(HX)=0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com