
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2 , 氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式。
(2)298 K时,在2L恒容密闭容器中发生反应:2NO2(g) ![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。
下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是;
③在c点,溶液中各离子浓度由大到小的排列顺序是。
【答案】
(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1
(2)6.67L/mol;d;<
(3)b;d;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】解:(1)1g燃料完全燃烧释放出的能量为42.5kJ,则1mol偏二甲肼完全燃烧释放出的能量为42.5kJ×60=2550kJ,其热化学方程式为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
所以答案是:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,
则K=![]() =
=![]() =6.67L/mol,
=6.67L/mol,
所以答案是:6.67L/mol;
②a、压强越大,反应速率越快,所以A、C两点的反应速率:A<C,故a错误;
b、混合气体的平均相对分子质量=![]() , BC两点混合气体的质量和物质的量都相等,所以混合气体的平均相对分子质量B=C,故b错误;
, BC两点混合气体的质量和物质的量都相等,所以混合气体的平均相对分子质量B=C,故b错误;
c、NO2的含量越高,混合气体的颜色越深,C点压强大于A点,加压平衡向生成N2O4的方向移动,但NO2的浓度比原平衡大,所以混合气体的颜色A点浅C点深,故c错误;
d、可逆反应2NO2(g)N2O4(g)△H=-a kJmol-1 (a>0)放热,温度升高平衡逆向移动,二氧化氮含量增大,所以由状态B到状态A,可以用加热的方法,故d正确;
所以答案是:d;
③反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,N2O4的浓度为0.3mol/L,浓度商Q=![]() =
=![]()
=6.67L/mol=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
所以答案是:<;
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+ , 溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,因此水的电离程度最大的是b点,溶液中c(OH-)的数值最接近NH3H2O的电离常数K数值,
所以答案是:b;
②氨水为弱碱,溶液呈碱性,c点溶液呈中性,铵根离子浓度过大,e点溶液碱性过强,一水合氨浓度过大,相对而言d点溶液中铵根离子浓度与一水合氨浓度最接近,溶液中c(OH-)的数值最接近NH3H2O的电离常数K数值,
所以答案是:d;
③c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,b点时c(Na+)=c(SO42-),c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
所以答案是:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).


科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2 , 将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4 , 其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:![]() -2e-+H2O=
-2e-+H2O=![]() +2H+
+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是
①观察颜色;②石蕊试剂;③品红溶液
A. ①②③ B. 只有①③ C. 只有②③ D. 只有①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气的成分有多种,乙酸苯甲酯( ![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: 
(1)C的结构简式为 , B中含氧官能团的名称是 .
(2)实验室检验A的方法是: .
(3)写出反应①、⑤的化学方程式:
① ;
⑤ .
(4)反应③、④的反应类型分别为③、④ .
(5)反应(填序号)原子的理论利用率为100%,符合“绿色化学”的要求.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基:  +2HCO3﹣→
+2HCO3﹣→  +2H2O+2CO2↑
+2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置可用于制取乙炔. 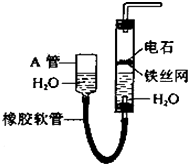
请填空:
(1)A管的作用是 , 制取乙炔的化学方程式是 .
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 , 乙炔发生了反应.
(3)乙炔通入溴水的CCl4溶液中观察到的现象是 .
(4)为了安全,点燃乙炔前应 , 乙炔燃烧时的实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
(1)A、B、C、D代表的物质分别为、、、(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是;
(3)反应②中,若B与F物质的量之比为4:3,G、H分别是、(填化学式);
(4)反应③产物中K的化学式为;
(5)反应④的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Ca3(PO4)2、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
(1)上述反应中,属于置换反应的是[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]。
(2)高温下进行的反应Ⅱ的化学方程式为;固体废弃物CaSiO3可用于。(答一条即可)
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为。
(5)指出(VI)这一环节在工业生产上的意义。
(6)写出由P→H3PO4的有关反应式:
①。
②。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法正确的是( ) 
A.N4分子属于一种新型的化合物
B.N4分子中只含有共价键
C.1 mol N4分子所含共价键数为4NA
D.N4沸点比P4(白磷)高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com