
【题目】由Ca3(PO4)2、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
(1)上述反应中,属于置换反应的是[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]。
(2)高温下进行的反应Ⅱ的化学方程式为;固体废弃物CaSiO3可用于。(答一条即可)
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为。
(5)指出(VI)这一环节在工业生产上的意义。
(6)写出由P→H3PO4的有关反应式:
①。
②。
【答案】
(1)(Ⅰ)、(Ⅲ)
(2)Ca3(PO4)2+5C+3SiO2![]() 3CaSiO3+2P+5CO↑;生产水泥(砖瓦或作为建筑材料等)
3CaSiO3+2P+5CO↑;生产水泥(砖瓦或作为建筑材料等)
(3)SiHCl3会水解,同时产生的H2 , 与O2混合发生爆炸
(4)CH3OH+H2O-6e-=CO2↑+6H+
(5)原料的循环利用,节能减排
(6)P+O2 ![]() P2O5;P2O5+3H2O=2H3PO4
P2O5;P2O5+3H2O=2H3PO4
【解析】解:(1)根据置换反应的定义知,反应II中反应物中有两种化合物,生成物中含有两种化合物,所以不是置换反应,反应IV中反应物没有单质,所以不是置换反应,反应V是化合反应,Ⅰ、Ⅲ反应符合置换反应的条件,所以是置换反应,
所以答案是:(Ⅰ)、(Ⅲ);
(2)高温条件下,磷酸钙和碳、二氧化硅反应生成硅酸钙、磷和一氧化碳,反应方程式为:Ca3(PO4)2+5C+3SiO2![]() 3CaSiO3+2P+5CO↑,硅酸钙属于硅酸盐,所以可以生产水泥、砖瓦或作为建筑材料等,
3CaSiO3+2P+5CO↑,硅酸钙属于硅酸盐,所以可以生产水泥、砖瓦或作为建筑材料等,
所以答案是:Ca3(PO4)2+5C+3SiO2![]() 3CaSiO3+2P+5CO↑;生产水泥、砖瓦或作为建筑材料等;
3CaSiO3+2P+5CO↑;生产水泥、砖瓦或作为建筑材料等;
(3)R为Si,反应Ⅲ是Si与HCl发生反应得到SiHCl3与氢气,由反应Ⅳ可知,SiHCl3会水解,且生成的氢气和氧气在一定范围内会产生爆炸,故需在隔绝氧气和无水条件下进行,
所以答案是:SiHCl3会水解,同时产生的H2 , 与O2混合发生爆炸等;
(4)甲醇发生氧化反应,酸性条件下,甲醇在负极失电子生成二氧化碳与氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+ ,
所以答案是:CH3OH+H2O-6e-=CO2+6H+;
(5)(Ⅵ)这一环节在工业生产上的意义:原料的循环利用,节能减排,
所以答案是:原料的循环利用,节能减排;
(6)由P→H3PO4 , 先由磷与氧气转化为五氧化二磷,再与水化合得到磷酸,有关方程式为①P+O2=P2O5、②P2O5+3H2O=2H3PO4 ,
所以答案是:P+O2=P2O5;P2O5+3H2O=2H3PO4 .


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8g O2含有4NA个电子
B.1L 0.1molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4L盐酸含有NA个HCl分子
D.1mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2 , 氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式。
(2)298 K时,在2L恒容密闭容器中发生反应:2NO2(g) ![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。
下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是;
③在c点,溶液中各离子浓度由大到小的排列顺序是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子
A. Fe2+ B. Fe3+ 和Fe2+ C. Cu2+ 和Fe2+ D. Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为。
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为。
(3)上述反应中断裂和生成的化学键有(填序号)。
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是。
(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
下图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
①该温度是。
②铜原子的配位数是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景. 甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.
某实验小组设计了如图所示的甲醇燃料电池装置.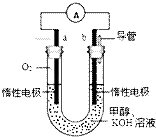
①该电池工作时,通入氧气的电极名称为 , 电极反应式为 . 另一电极反应式为 . 氢氧根离子流向极(填正或负)
②工作一段时间后,测得溶液的碱性(填增强或减弱).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,发生反应:2X(g)+Y(g)Z(g)△H=﹣197kJmol﹣1 , 若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
A.10min内,反应放出的热量为197kJ热量
B.10min内,X的平均反应速率为0.06molL﹣1min﹣1
C.第10min时,Y的反应速率小于0.015molL﹣1min﹣1(假如体系温度不变)
D.第10min时,Z浓度为0.6molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com