
【题目】下列有关化学反应方向的描述中正确的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.知道了某过程有自发性之后,可预测反应过程发生的快慢
C.CaCO3(s)![]() CaO(s)+CO2(g) △H>0,该反应能否自发进行与温度无关
CaO(s)+CO2(g) △H>0,该反应能否自发进行与温度无关
D.冰融化为水的过程中:△H<0,△S>0
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是

A. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
B. a、b两点所示溶液中水的电离程度a点大于b点
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. 一元酸HA为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如图:
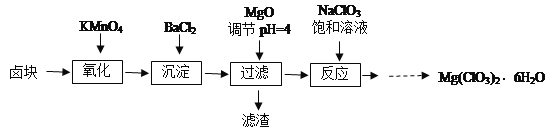
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
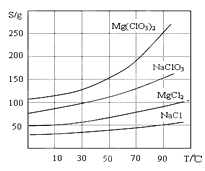
②四种化合物的溶解度(S)随温度(T )变化曲线如图所示:
(1)过滤所需要的玻璃仪器有______。
(2)如图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
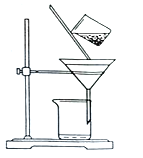
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(3)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀全?______
(4)加入NaClO3饱和溶液会发生如下反应:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,请利用该反应,结合图像,制取Mg(ClO3)2·6H2O的实验步骤依次为:①取样,加入NaClO3饱和溶液充分反应,②______;③______;④______;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜与稀硝酸反应的有关性质实验(洗耳球:一种橡胶为材质的工具仪器,可挤压)。
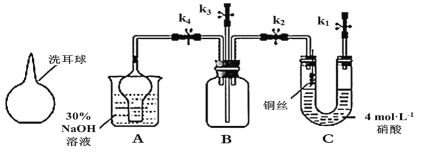
实验步骤如下:
①按照如图装置连接好仪器,关闭所有止水夹。检查装置的气密性。
②在装置A中的烧杯中加入30%的氢氧化钠溶液。在装置C的U型管中加入4.0mol·L-1的硝酸,排除U型管左端管内空气。
③塞紧连接铜丝的胶塞,打开止水夹K1,反应进行一段时间。
④进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色。气体进入烧杯中与氢氧化钠溶液反应。
回答下列问题:
(1)装置C中发生反应的离子方程式为__。反应后的溶液呈蓝色,其原因是铜离子和水分子形成了水合铜离子,1mol水合铜离子中含有σ键数目为12NA,该水合铜离子的化学式为__。
(2)装置A上面的导管口末端也可以连接__来代替干燥管,实现同样作用。
(3)加入稀硝酸,排除U型管左端管内空气的操作是__。
(4)步骤④中“使装置C中产生的气体进入装置B的广口瓶中”的操作是打开止水夹__(填写序号),并用洗耳球在U型管右端导管口挤压空气进入。
(5)步骤④中使“气体进入烧杯中与氢氧化钠溶液反应”的操作是__,尾气中主要含有NO2和空气,与NaOH溶液反应只生成一种盐,则离子方程式为有__。
(6)某同学发现,本实验结束后硝酸还有很多剩余,请你改进实验,使能达到预期实验目的,反应结束后硝酸的剩余量尽可能较少,你的改进是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置做铝热反应实验,回答下列问题:
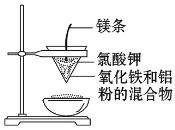
(1)写出该反应的化学方程式:___,在该反应中___是氧化剂,___是还原剂,该反应称为___反应。
(2)选出该实验的实验现象(把序号填写在横线上):___。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:___;蒸发皿盛沙:___;镁条:___;氯酸钾:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与CO2重整生成H2和CO的过程中主要发生下列反应
![]()
![]()
在恒压、反应物起始物质的量比![]() 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是

A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
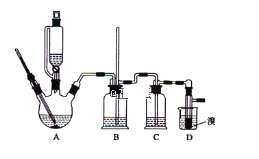
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为
![]()
实验步骤如下:
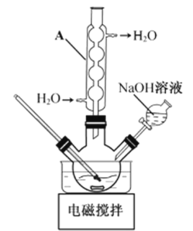
步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是___________;逐步加入NaOH溶液的目的是____________。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_______________。
(3)步骤3中,粗产品溶解于过量水会导致产率__________(填“增大”或“减小”);去除活性炭的操作名称是_______________。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com