
【题目】元素R可形成化学式为Na2RO4的一种盐,则R是( )
A.FB.NC.SD.Cl
科目:高中化学 来源: 题型:
【题目】由Li、Al、Si构成的某三元化合物固态晶胞结构如图所示,下列说法不正确的是
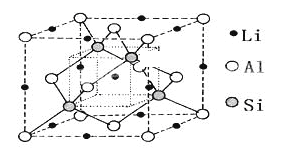
A. 晶体中Al和Si构成金刚石型骨架 B. 该化合物化学式可表示为LiAlSi
C. 晶体中与每个Al距离最近的Li为6个 D. 晶体中Al和Li构成CsCl型骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸性H2CO3>HClO>HCO3—,下列有关叙述中正确的是
①向NaClO溶液中通入少量二氧化碳的离子反应方程式为:2ClO—+CO2+H2O=2HC1O+CO32—
②向KI和KBr混合溶液中,加入足量FeCl3溶液,用CCl4萃取后取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水。反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl—
④卫生间的洁厕灵不能跟84消毒液混用,其离子方程式为:ClO—+Cl—+2H+=Cl2↑+H2O
A.②④ B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为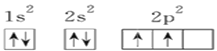
D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中的离子能大量共存的是( )
A.H+、K+、OH-、Cl-B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-D.Ba2+、K+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
B. 苯、苯酚、己烯只用一种试剂就可以鉴别
C.  用系统命名法叫2-甲基-1-丙醇
用系统命名法叫2-甲基-1-丙醇
D. 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷
的名称为2,5,6-三甲基-4-乙基庚烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用周期表中同主族元素的相似性,可预测元素的性质。
(1)白磷的分子式为P4,其结构如图甲所示。科学家目前合成了N4分子,N原子的杂化轨道类型是______;N4分解后能产生N2并释放出大量能量,推测其用途为____________。
(2)N、P、As原子的第一电离能由大到小的顺序为___________。
(3)比较酸性:HNO3_______HNO2(填“强于”或“弱于”),原因是___________________
(4)立方氮化硼晶体的结构如图乙所示。该晶体中,B原子填充在N原子的______(填空间构型名称)空隙中,且占据此类空隙的比例为________(填百分数)。


(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为______;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 _______________(列出计算式,不需要计算出结果)。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的结构示意图为 ,由此得到的结论不正确的是
,由此得到的结论不正确的是
A. 该原子有3个电子层B. 该元素属于金属元素
C. 该原子在化学反应中易得2个电子D. 该元素的最高正化合价为+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com