
【题目】向四只盛有相同量NaOH溶液的烧杯中通入不同量的CO2气体,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发),则下列分析都正确的组合是

对应图象 | 溶液中的主要成分 | |
A | Ⅰ | NaOH、NaHCO3 |
B | Ⅱ | NaHCO3、Na2CO3 |
C | Ⅲ | NaOH、Na2CO3 |
D | Ⅳ | Na2CO3 |
A. A. B. B C. C D. D
【答案】B
【解析】
A.若氢氧化钠过量,溶液中不会存在碳酸氢钠,所以溶液的主要成分不可能为:NaOH、NaHCO3,A错误;
B.溶液溶质为NaHCO3、Na2CO3,说明二氧化碳部分过量;加入氯化氢后,先发生反应Na2CO3+2HCl=NaCl+NaHCO3,碳酸钠反应完全后开始生成二氧化碳气体,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,图象中数据合理,B正确;
C.反应后生成物为NaOH、Na2CO3,说明二氧化碳不足,加入的氯化氢先与氢氧化钠反应,然后与碳酸钠反应生成碳酸氢钠,之后开始生成二氧化碳;根据反应Na2CO3+2HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O可知,生成二氧化碳气体之前消耗的氯化氢的物质的量应该大于碳酸氢钠消耗的氯化氢,图象恰好相反,C错误;
D.由反应方程式Na2CO3+2HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O可知,开始生成二氧化碳消耗的氯化氢的物质的量应该与碳酸钠消耗的氯化氢的物质的量相等,图示中不相等,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】碳碳双键有如下所示的断裂方式:
 ;
;
 。
。
高分子单体A(C6H10O3)可进行如下反应(反应框图)

已知:
Ⅰ.对框图中某些化合物性质的说明:A在室温下不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na反应放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na反应放出H2。
Ⅱ.两个一OH连在同一个C原子上的结构不稳定。
(1)写出反应①中(1)的反应类型:___________;写出D的键线式:____________________。
(2)写出物质E所含官能团的名称: ____________________。
(3)B在浓H2SO4存在下与甲醇共热反应生成的有机物的系统名称为____________________。
(4)写出F→G的化学反应方程式:____________________________________。
(5)与B互为同分异构体,分子为链状的酯类物质共有______________种(不考虑立体异构)。
(6)请设计合理方案,用物质E制备乙二酸(其他原料自选,用反应流程图表示,并注明必要的反应条件) ______________。例如:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
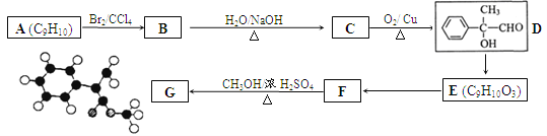
试回答:
(1)G的分子式为 ____________。
(2)A的结构简式为 ___________;D中官能团的名称为 __________。
(3)B→C反应的化学方程式是 ____________________________。
(4)E的同分异构体中可用通式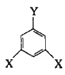 表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
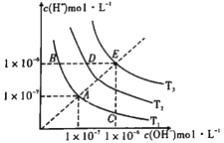
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在工业上的应用十分广泛。请回答下列问题:
(1)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式)_______。
(2)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中A1N的质量分数,进行了以下实验:称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中A1N的质量分数,进行了以下实验:称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①AlN跟NaOH溶液反应的化学方程式为________________________;
②该样品中的A1N的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学的发展离不开物质结构的探索和研究。物质结构研究对于保护生态环境、实现社会的可持续发展有重要的意义。请回答下列问题:
(1)基态铜原子最外层电子所占用能级的电子云轮廓图形状为_____,基态硒原子的价电子排布图为____。
(2)次氯酸分子的VSEPR模型名称为_______,中心原子的杂化类型为_________。
(3)C、O、F三者的第一电离能由小到大的顺序为___________。
(4)CaO的熔点比BaO(填“高”或“低”),原因是______。
(5)H2SeO4的酸性比H2SeO3强,原因是_________。
(6)与CN-互为等电子体的离子有________(写出一种即可)。
(7)Fe和S形成的某种晶胞如图所示:其中白球表示S,黑球表示Fe,则该物质的化学式为_______.该晶胞中硫原子的配位数为_______;假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为__________pm.
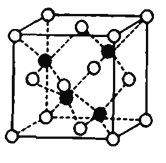
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com