
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的结构简式是CH2CH2
B.乙酸和乙醇都既能与钠反应产生气体,又能与碳酸钠反应产生气体
C.C4H10的一氯取代物共有4种
D.标准状况下,22.4L氯仿中含有3molCl原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各地对食品非法添加和滥用添加剂进行了多项整治活动。其中常用的面粉增白剂过氧化苯甲酰(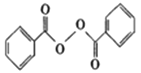 )也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
)也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
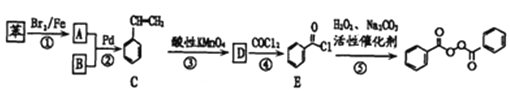
已知:![]()
请回答下列问题:
(1)工业上物质B主要来源于_____,物质D的名称是_______;每个C分子中最多有____个原子共平面。
(2)结合过氧化苯甲酰结构分析,过氧化苯甲酰可以作为增白剂的原因是________。
(3)写出反应②的化学方程式________,反应类型为________。
(4)某物质F为过氧化苯甲酰的同分异构体,同时符合下列条件的F的同分异构体有______种,请写出其中有三种不同化学环境的氢原子的结构简式:____________。
① 含有联苯(![]() )结构单元.无其他环状结构
)结构单元.无其他环状结构
② 在一定条件下能发生银镜反应
③ 1mol F最多可消耗4mol NaOH
(5)请写出以苯乙烯为原料,合成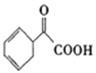 的流程,无机试剂任选,注明反应条件。____________
的流程,无机试剂任选,注明反应条件。____________
示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )

A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol N2与0.3 mol H2 在一定条件下充分反应,生成的气体分子数为0.2NA
B. 15g冰醋酸和葡萄糖的混合物,含有的原子数为2 NA
C. 5.6 g铁与足量稀盐酸反应,产生2.24 L气体
D. 300 mL2 mol/L乙醇水溶液中所含H原子数为3.6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 提取镁的过程涉及化合、分解、置换反应
D. 第④步电解时,还会产生副产品氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有相同量NaOH溶液的烧杯中通入不同量的CO2气体,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发),则下列分析都正确的组合是

对应图象 | 溶液中的主要成分 | |
A | Ⅰ | NaOH、NaHCO3 |
B | Ⅱ | NaHCO3、Na2CO3 |
C | Ⅲ | NaOH、Na2CO3 |
D | Ⅳ | Na2CO3 |
A. A. B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
A.NaCl、Cl2
B.NaHCO3、蔗糖
C.Ba(OH)2、HCl
D.H2SO4、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素常与H2O、NH3等形成配合物。
(1)写出Fe元素基态原子的价层电子排布式_______;
(2)C、N、O元素的第一电离能从大到小的顺序为___(用元素符号表示);
(3)向盛有硫酸铜水溶液的试管里加入过量氨水,得到蓝色溶液,铜离子形成了配位数为4的配离子,写出该配离子的结构式为______。
(4)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①甲分子的电子式为_________,分子构型为___________;
②1 mol乙分子含有___个σ键;
③丙分子的中心原子采取_______杂化轨道;
④甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是 ____________(结合具体物质解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com