
【题目】下表是元素周期表的一部分,请参照元素①~⑦在表中的位置,回答下列问题:
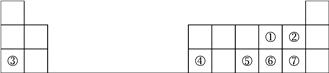
(1)①~⑦元素中原子半径最大的是__________(用元素符号表示);
(2)②⑦两种元素所形成的气态氢化物中最稳定的是__________(用化学式表示);
(3)⑤⑥两种元素最高价氧化物对应的水化物的酸性较强的是__________(用化学式表示);
(4)写出③④两种元素的最高价氧化物对应的水化物发生反应的离子方程式:_____________________________。
【答案】 Na HF H2SO4 Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
【解析】根据元素在周期表中的位置知,①~⑦分别是O、F、Na、Al、P、S、Cl元素。(1)同周期从左到右元素的原子半径依次减小,同主族从上而下元素的原子半径依次增大,故①~⑦元素中原子半径最大的是Na;(2)元素F的非金属性强于Cl,故②⑦两种元素所形成的气态氢化物HF、HCl中最稳定的是HF;(3)元素非金属性越强,其最高价氧化物的水化物的酸性越强,故⑤⑥两种元素最高价氧化物对应的水化物磷酸和硫酸的酸性较强的是H2SO4;
(4)③④两种元素的最高价氧化物对应的水化物氢氧化钠和氢氧化铝发生反应的离子方程式为:Al(OH)3+OH-=AlO![]() +2H2O。
+2H2O。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】向MgCl2、Al2(SO4)3的混合済液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如右图所示,则原溶液中SO42—与Cl—的物质的量之比是( )
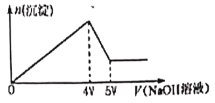
A. 1:2 B. 1:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)反应开始的化学方程式为_________________________________________;
(2)根据上述实验现象,表明硝酸具有_____________填序号;
①酸性 ②不稳定性 ③强氧化性
(3)用V L的试管装满NO2气体,并倒扣在足量的水中,待试管中液面不再上升时,试管中溶液的浓度为_____________;(气体摩尔体积用Vm表示)
(4)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________离子方程式;
(5)若将12.8g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6L标准状况,则所消耗的硝酸的物质的量是_____________,反应中转移的电子的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应,2R—C≡C—H![]() R—C≡C—C≡C—R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R—C≡C—C≡C—R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
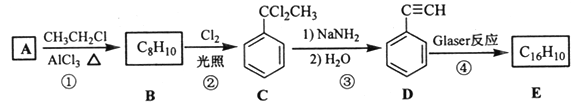
回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
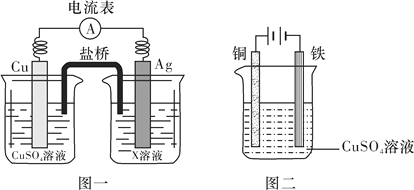
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
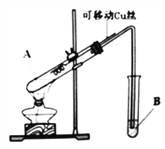
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素![]() )等。每100克黑木耳含铁高达185毫克。
)等。每100克黑木耳含铁高达185毫克。
ii.紫色的![]() 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的![]() 。
。
I:为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
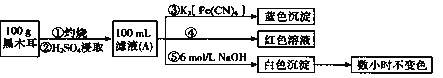
(1)步骤②得到滤液A的操作是_________。
(2)步骤④检验![]() 所用试剂是_________溶液。
所用试剂是_________溶液。
(3)下列有关上述实验得出的结论是_____(填字母符号)。
a.黑木耳中一定含![]() 和
和![]()
b.滤液A中一定含![]() 和
和![]()
c.白色沉淀中一定含![]()
II:为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
![]()
(4)可选作试剂B的物质是__________(填字母序号)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
(5)步骤⑦中观察到的实验现象是_________,反应的离子方程式是____________。
(6)若同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校甲、乙两个化学小组学生利用下图所示装置进行“铁与水反应及相关性质”的实验。
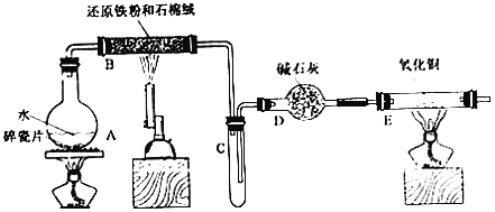
(1)装置B中发生反应的化学方程式是____________________________________。
(2)装置E中的现象是___________________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________________________。
②甲组步骤1中反应的离子方程式为______________________________________。
③乙组步骤4中,溶液变红的原因为____________________、___________________;(用离子方程式表示);溶液褪色可能的原因是_____________________________;验证方法为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com