
【题目】实验室制备溴苯可用下图所示装置。请回答下列问题:

(1)关闭G夹,打开B夹,从装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为___________________。
(2)试管C中苯的作用是_________________。试管D中出现的现象是______________。试管E中出现的现象是_______________。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开G夹,关闭B夹,可以看到的现象是__________________。
(4)三颈烧瓶中的溴苯经过下列步骤分离提纯:
①向三颈烧瓶中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是除去多余的溴;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是干燥产品。
④经过上述分离操作后,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母)。
A 重结晶 B 过滤 C 蒸馏 D 萃取
【答案】![]() +Br2
+Br2 ![]()
![]() +HBr 吸收挥发出来的溴蒸气 D中有白雾,试液变红 E中出现淡黄色沉淀 广口瓶中的水沿导管进入三颈烧瓶中、三颈烧瓶中液体出现分层 C
+HBr 吸收挥发出来的溴蒸气 D中有白雾,试液变红 E中出现淡黄色沉淀 广口瓶中的水沿导管进入三颈烧瓶中、三颈烧瓶中液体出现分层 C
【解析】
关闭G夹,打开B夹,向装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中Fe和溴反应生成溴化铁,在溴化铁作催化剂条件下苯和溴发生取代反应生成溴苯,同时还生成HBr,HBr水溶液呈酸性,能使石蕊试液变红色,溴和苯均具有挥发性,溴能和水反应生成的HBr,也能和硝酸银反应生成AgBr淡黄色沉淀,据此分析解答。
(1)Fe和溴反应生成溴化铁,在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯,反应的化学方程式为![]() +Br2
+Br2 ![]()
![]() +HBr,故答案为:
+HBr,故答案为:![]() +Br2
+Br2 ![]()
![]() +HBr;
+HBr;
(2)液溴易挥发,溴极易溶于苯,用苯可以除去溴化氢气体中的溴蒸气,以防干扰H+和Br-的检验,生成的HBr遇到水生成氢溴酸小液滴而产生白雾,石蕊试液遇酸变红色,所以D中产生白雾且试液变红色;溴离子和银离子反应生成淡黄色沉淀,E中生成淡黄色沉淀,故答案为:吸收挥发出来的溴蒸气;D中有白雾,试液变红;E中出现淡黄色沉淀;
(3)由于溴化氢极易溶于水,所以待三颈烧瓶中的反应进行到仍有气泡冒出时松开G夹,关闭C夹,可以看到的现象是与B相连的广口瓶中水流入三颈烧瓶,溴苯不溶于水,所以A中会出现分层,故答案为:广口瓶中的水沿导管进入三颈烧瓶中、三颈烧瓶中液体出现分层;
(4)④苯易溶在溴苯中,且和氢氧化钠溶液不反应,所以粗溴苯中还含有的主要杂质为苯,二者的沸点相差较大,蒸馏即可分离,故答案为:C。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是( )
W(s)+3H2O(g),下列说法不正确的是( )
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)、H2(g)的生成速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L SO3中含原子数为0.2NA
B.10 mL 12 mol/L 浓盐酸与足量MnO2加热反应,制得氯气的分子数0.03NA
C.0.1 mol CH4与0.4 mol Cl2在光照下充分反应,生成CCl4的分子数为0.1NA
D.常温常压下,6 g乙酸中C-H键的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的种类繁多,但其命名是有规则的。下列有机物命名正确的是( )
A.![]() 2—甲基—3—丁炔
2—甲基—3—丁炔
B. 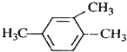 1,3,4—三甲苯
1,3,4—三甲苯
C. CH3﹣C(CH3)=CH﹣CH3 3—甲基—2—丁烯
D.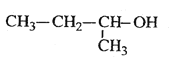 2—丁醇
2—丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述错误的是( )
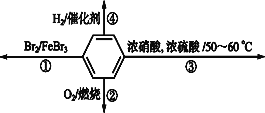
A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种芳香化合物
D.反应④中1 mol苯最多与3 mol H2在催化剂作用下发生加成反应,说明苯具有类似烯烃的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Ni原子价电子中成对电子数与未成对电子数之比为_______.。
(2)已知FeF3 具有较高的熔点(熔点高于1000℃),FeBr3 的式量大于FeF3,但其熔点只有200℃,原因是_____________________________________________________________________。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+,1mol该配离子中所含σ键的数目为____,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为________。
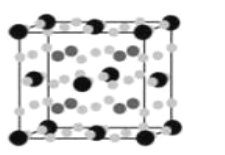
(4)金属Fe与Mg、H形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表Fe,深灰色小球代表Mg,浅灰色小球代表H,其中浅灰色小球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:__________________。

(5)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用现代科技从苦艾精油中分离出多种化合物,其中四种的结构如下:

下列说法不正确的是( )
A.②③分子中所有碳原子不可能处于同一平面内
B.②④互为同分异构体
C.④的一氯代物有6种
D.①②③均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A. 次氯酸的电离方程式:HClO===H++ClO-
B. 铝溶于烧碱溶液的离子方程式:Al+2OH-==AlO2-+H2↑
C. 电解精炼铜的阴极反应式:Cu-2e-==Cu2+
D. 已知中和热为57.3 kJ·mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:____________。
(2)与N3-互为等电子体的分子有:______(写一种)由此可推知N3-的空间构型是:_________; 比较NH2-和NH3的键角∠HNH的大小:NH2- ____ NH3(填“>”或“<”或“=”),请用价层电子对互斥规律解释_______。
(3)叠氮化钠(NaN3)分解可得纯N2,有关说法正确的是:________(选填代号)
A.氮气常温下很稳定,是因为氮元素的电负性大
B.NaN3与KN3结构类似,前者晶格能较小
C.第一电离能(I1):N>P>S
D.热稳定性NH3强于PH3和H2S是因为NH3分子间有氢键
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3 = 3Na2O + 2Fe+ 9N2 ;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如下图所示):
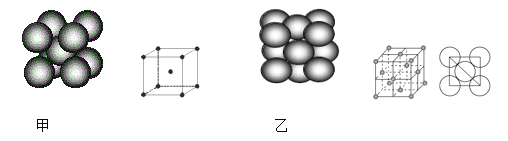
晶胞甲中铁原子的配位数为:_______,晶胞乙中铁原子的堆积方式为:________。晶胞乙中铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为M g/mol。则该晶体的密度可表示为:___________ g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com