
(6分)现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH—、C1—、CO32—、NO3—、SO42— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是 。(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度 倍。
(3)将0.1 mol·L-1 的C溶液逐滴加入等体积、0.2 mol·L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为: 。
(1)CO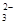 +H2O
+H2O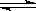 HCO
HCO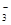 +OH- (各2分)
(2)106(2分)
+OH- (各2分)
(2)106(2分)
(3) c(Na+)>c(HCO3-)> c(Cl-)>c(CO32-)>c(OH-)>c(H+)(2分)
【解析】D溶液与另外四种溶液反应都能产生沉淀,说明D中移动含有Ag+,所以D是硝酸银。由于CO32-只能和钠离子结合,所以A或B是碳酸钠。又因为氯化钡显中性,所以不可能有氯化钡,而是氢氧化钡,即A或B是氢氧化钡。根据②可知B是氢氧化钡,E是硫酸铝,则A是碳酸钠,C是盐酸。
(1)碳酸钠水解显酸性,方程式为CO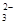 +H2O
+H2O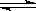 HCO
HCO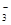 +OH- 。
+OH- 。
(2)盐酸抑制水的电离,硫酸铝促进水的电离。所以E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度10-4÷10-10=106倍。
(3)根据盐酸和碳酸钠的物质的量可知,二者恰好反应生成碳酸氢钠和氯化钠,所以反应后溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)> c(Cl-)>c(CO32-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:阅读理解
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.



查看答案和解析>>
科目:高中化学 来源: 题型:








查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
| D的单质 |
| D的单质 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com