
【题目】铁、铝的混合物进行如下实验:

(1)操作X的名称是________________;
(2)气体A是___________(填化学式);
(3)溶液B中阴离子除OH- 外还有__________(填离子符号),溶液D中存在的金属离子为_________(填离子符号);
(4)加入足量NaOH溶液时发生反应的离子方程式为:_________;加入稀盐酸发生反应的离子方程式为:___________________________________________;
(5)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________。
【答案】过滤 H2 AlO2- Fe2+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Fe+2H+=Fe2++H2↑ 4 Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
根据题干给出的实验步骤及铝和铁及其化合物的性质分析解答。
金属铁和金属铝的混合物中加入氢氧化钠后,会和金属铝发生反应生成偏铝酸钠和氢气,金属铁和氢氧化钠不反应,所以A是氢气,B是偏铝酸钠和过量的氢氧化钠的混合物,固体C是金属铁,金属铁可以和盐酸反应生成氯化亚铁和氢气,所以D是氯化亚铁。
(1)实现金属铁和偏铝酸钠、氢氧化钠混合物分离的方法是过滤,故答案为:过滤;
(2)气体A是氢气,故答案为:H2;
(3)溶液B是偏铝酸钠和过量的氢氧化钠的混合物,铁可以和盐酸反应生成氯化亚铁和氢气,D是氯化亚铁,故答案为:AlO2-;Fe2+;
(4)根据离子方程式的书写规则得:2Al+2OH-+2H2O=2AlO2-+3H2↑;Fe+2H+=Fe2++H2↑
(5)颜色的变化是白色的氢氧化亚铁沉淀被氧化成红褐色的氢氧化铁,方程式为:4 Fe(OH)2+O2+2H2O=4Fe(OH)3。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如下:

回答下列问题:
(1)I中含氧官能团的名称为___________________。
(2)由B生成C的化学方程式为_______________________________。
(3)由E和F反应生成D的反应类型为_______,由G和H反应生成I的反应类型为______。
(4)仅以D为单体合成高分子化合物的化学方程式为_________________ 。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式_________________ 。
(6)参照本题信息,试写出以1-丁烯为原料制取 的合成路线流程图(无机原料任选)__________ 。
的合成路线流程图(无机原料任选)__________ 。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化的须色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。完成下列问题:
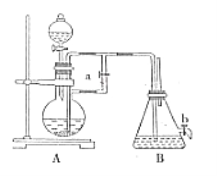
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_______________,A中发生反应的目的是_____________________________。
(2)实验开始时应先将弹簧夹a________(填“打开”或“关闭”)。
(3)装置B中生成Fe(OH)2的操作及观察到的现象为_______________。
(4)实验完毕,打开b处弹簧夹,放入一部分空气,此时B中发生的反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④电镀过程相当于金属的“迁移”,可视为物理变化
A. ③B. ③④C. ②③④D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于镁合金具有硬度大、密度小、散热性好、抗震性好等优异性能它被用于制笔记本电脑外壳、竞赛自行车车架等。现称取一定质量的镁铝合金样品放入500 mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。

(1)合金中Al的质量为__________________。
(2)NaOH溶液的物质的量浓度为__________________。
(3)稀硫酸的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol O2在放电条件下发生下列反应:3O2![]() 2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
A. 16 B. 17.8 C. 18.4 D. 35.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)根据等电子体原理,在NO中氮原子轨道杂化类型是__________;1 mol O![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。
(4)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1,测知FexO晶体密度ρ=5.71 g·cm-3,晶胞边长为4.28×10-10m。
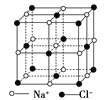
(1)FexO中x值(精确至0.01)为________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为________。
(3)此晶体的化学式为________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是________。
(5)在晶体中,铁离子间最短距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)分离胶体和溶液常用的方法叫______________。
(2)除去KNO3溶液中少量杂质AgNO3,可选择加入___________溶液,然后过滤。
(3)已知下列六种物质:熔融KI 、Cl2 、CaCO3固体 、食盐晶体、石墨 、盐酸 ,能导电的电解质是_______________。
(4)100克质量分数46%的酒精(C2H6O)水溶液中含氧原子_________NA。
(5)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com