
【题目】用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是
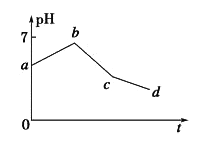
A. ab段H+被还原,溶液的pH 增大
B. cd 段相当于电解水
C. c点时加人适量CuCl2固体,电解液可恢复原来浓度
D. 原溶液中KCl和CuSO4的物质的量浓度之比为2:1
【答案】B
【解析】用惰性电极电解等体积的KCl和CuSO4混合溶液,阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:第一阶段:阳极上电极反应式为2Cl--2e-=Cl2↑、阴极电极反应式为Cu2++2e-=Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;第二阶段:阳极上电极反应式为4OH--4e-=2H2O+O2↑,阴极反应先发生Cu2++2e-=Cu,反应中生成硫酸,溶液pH降低;第三阶段:阳极电极反应式为4OH--4e-=2H2O+O2↑、阴极电极反应式为2H++2e-=H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低。
A.ab段由于铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升,铜离子为被还原,A错误;B.由上述分析可知,cd 段相当于电解水,B正确;C.电解至c点时,溶液中溶质为硫酸、硫酸钾,往电解液中加入适量CuCl2固体,不能使电解液恢复至原来的浓度,C错误;D.图象中具体数量关系未知,不能计算原混合溶液中KCl和CuSO4的浓度之比,D错误,答案选B。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装标签上印有警示性标志。下列化学药品名称与警示标志名称对应正确的是( )
A.浓硫酸——腐蚀品B.酒精——剧毒品
C.汽油——爆炸品D.烧碱——剧毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝不易发生化学反应
D.铝易氧化,形成的氧化膜有保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中碳循环(如图)的说法中,不正确的是( ) 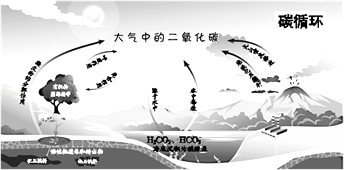
A.呼吸作用涉及氧化还原反应
B.碳循环具有全球性
C.含碳化合物可相互转化
D.碳元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-Q kJ/mol(Q>0)。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,上述三个过程对应的能量变化值分别为Q1、Q2、Q3。下列说法正确的是
CO2(g)+H2(g) ΔH=-Q kJ/mol(Q>0)。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,上述三个过程对应的能量变化值分别为Q1、Q2、Q3。下列说法正确的是
A. 2Q1=2Q2<Q3
B. 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高
C. 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小
D. 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T3℃时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液.这三种物质的溶解度随温度而变化的曲线如图.从T3降至T1 , 下列有关说法正确的是( ) 
A.T3℃时,由A物质所形成的溶液的物质的量浓度最大
B.T2℃时,由A、C两物质形成的溶液质量分数相等
C.T1℃时,由B物质所形成的溶液质量分数最大,C的最小
D.从溶解度曲线可知分离A、C的混合溶液得到A可采用蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对人类的生存发展具有重要意义,科学家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一种固氮酶,能在常温下将空气中的氮气转化为自身生长所需的含氮化合物,下列说法错误的是____(填标号)。
a.固氮酶是一种蛋白质
b.固氮酶能降低固氮反应发生所需的能量
c.固氮酶能使固氮反应的平衡正向移动
d.固氮酶能加快固氮反应的速率
(2)合成氨是目前最重要的固氮方法。下图为合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
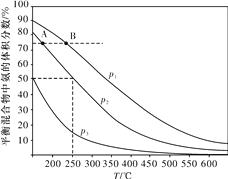
①A、B两平衡状态相比较,前者较大的是____(填标号)。
a.平衡常数
b.平衡混合物的平均摩尔质量
c.氢气的转化率
d.从反应开始至达到平衡状态所需要的时间
②图中p1、p2、p3由大到小的顺序为____。
③在250 ℃、p2下,H2的转化率为____%(结果保留小数点后一位)。
(3)据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和一种单质。已知:
①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.2 kJ/mol
2NH3(g) ΔH2=-92.2 kJ/mol
写出此条件下氮气和水反应的热化学方程式:___。
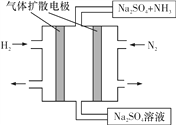
(4)下图为一种常温常压下水溶液中电化学合成氨的实验装置示意图。请据此写出其正极反应的电极反应式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质X和Y相互反应生成X2+和Y2-,现有下列叙述其中正确的是( )
①X被氧化 ②X是氧化剂 ③X具有氧化性
④Y2-是还原产物 ⑤Y2-具有还原性 ⑥X2+具有氧化性
A.①②③④B.①④⑤⑥C.②③④D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com