
����Ŀ����һ�������ȵĹ̶��ݻ����ܱ������п��淴Ӧ mA(g)��nB(g)![]() pC(g)��qQ(g)m��n��p��qΪ��������ʱ���ﵽƽ��ı�־��
pC(g)��qQ(g)m��n��p��qΪ��������ʱ���ﵽƽ��ı�־��
����ϵ��ѹǿ���ٸı� ����ϵ���¶Ȳ��ٸı� ������ֵ�Ũ�Ȳ��ٸı� ������ֵ������������ٸı� ����Ӧ����v(A)��v(B)��v(C)��v(Q)��m��n��p��q ����λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ
A. �ۢܢݢ� B. �٢ۢܢ� C. �ڢۢܢ� D. �٢ۢܢ�
���𰸡�C
��������������÷�Ӧ��һ����Ӧǰ�������������Ŀ��淴Ӧ������ϵ��ѹǿʼ�ղ��䣬���Բ��ܸ���ѹǿ�жϷ�Ӧ�Ƿ�ﵽƽ��״̬���ʴ�����ϵ���¶Ȳ��ٸı䣬���淴Ӧ������ȣ������ܾݴ��жϸ÷�Ӧ�ﵽƽ��״̬������ȷ���۸���ֵ����ʵ���Ũ�Ȳ��ٸı䣬�÷�Ӧ�ﵽƽ��״̬������ȷ���ܵ��÷�Ӧ�ﵽƽ��״̬������ֵ������������ٸı䣬����ȷ���ݸ��ݷ���ʽ���κ�ʱ���ڷ�Ӧ����v(A)��v(B)��v(C)��v(Q)��m��n��p��q�����ܾݴ��жϸ÷�Ӧ�Ƿ�ﵽƽ��״̬���ʴ���λʱ����mmolA�ϼ���Ӧ��Ч��pmolC�γɣ�ͬʱpmolCҲ�ϼ���Ӧ��˵�����淴Ӧ������ȣ�����ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.2mol/L ��NaOH��Һ980mL��������������
���ձ� ��100mL��Ͳ ��������ƽ�������룩 �ܲ����� �ݽ�ͷ�ι�
��1������ʱ������ʹ�õ�������___________������ţ�����ȱ�ٵIJ��������� ________����ʵ���������õ��������������÷ֱ���_______________��_________________��
��2��ʹ������ƿǰ������е�һ��������_____________________��
��3��������Һʱ��һ����Է�Ϊ���¼������裺��ȷ�IJ���˳���ǣ�_______________������ĸ��ʾ��ÿ����ĸֻ����һ�Σ���
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B����������ƽȷ��ȡ�����NaOH����������������ձ��У��ټ�������ˮ���ò���������������ʹ�����ܽ�
C��������ȴ����Һ�ز�����ע��1000mL������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
�ڢٲ����������NaOH_______g
��4���������������Щ��������������Ũ��ƫ����д��ĸ��___________________��
A����NaOH������ֽ�ϳ���
B����ȡNaOH������������
C������ƿδ���T����������Һ
D��NaOH���ձ����ܽ��δ��ȴ������ת�Ƶ�����ƿ�У������ж��ݣ�
E��������ƿת��ʱ��������Һ�彦��
F��������ƿ�ж���ʱ��������ͼ��ʾ

G���ձ�δ����ϴ��
H�����ݺ�����ƿ������ҡ�ȣ����ú�Һ�治���̶��ߣ��ټ�ˮ���̶��ߡ�
��5��������ʱ��С��ʹҺ�泬���˿̶��ߣ�Ӧ��ȡ�Ĵ�ʩ��_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�U����Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ��ʳ��ˮ���Ȼ����Һ��������һ�������飬����һ��ʱ�䡣�����й�������ȷ����
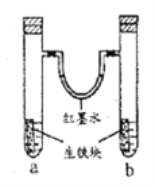
A. �������е�̼��ԭ��صĸ���
B. ��īˮ�����ߵ�Һ���Ϊ����Ҹ�
C. ���Թ�����ͬ�ĵ缫��Ӧʽ��:Fe-2e-=Fe2+
D. a�Թ��з��������ⸯʴ��b�Թ��з�����������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ȼҵ���Զ��Ե缫��ⱥ��ʳ��ˮ����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
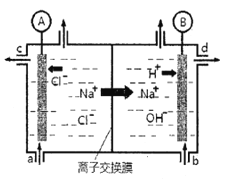
����������:
��д����ⱥ��ʳ��ˮ�����ӷ���ʽ_________��
�����ӽ���Ĥ������Ϊ:__________��__________��
������������Һ��ͼ��_____λ��������(ѡ��a��b��c��d)
��2����֪��ǿ���Ի����У�Fe(OH)3����KClO��Һ���ö�����FeO42-��
�ٴ˷�Ӧ�����ӷ���ʽ��_________��
�ڸ��������һ�����͵ij���أ��ܷ�ӦΪ:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,�ŵ�ʱÿת��6mol���ӣ���_____mol K2FeO4����ԭ���ŵ�ʱ����������Һ��pH_________ (��������������С������������); ���ʱ������ӦʽΪ:_____��
3Zn(OH)2+2Fe(OH)3+4KOH,�ŵ�ʱÿת��6mol���ӣ���_____mol K2FeO4����ԭ���ŵ�ʱ����������Һ��pH_________ (��������������С������������); ���ʱ������ӦʽΪ:_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ò��缫���100mL HNO3 �� AgNO3�Ļ��Һ��ͨ��һ��ʱ����������ռ���2.24 L���壨��״��������ԭ���Һ��Ag+�����ʵ���Ũ��Ϊ �� ��
A. 1mol/L B. 2mol/L C. 2.5mol/L D. 3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH3D+�У�����������������������֮��Ϊ�� ��
A.10��7��11
B.11��11��8
C.10��11��8
D.11��8��10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ����Ҫ�Ļ�����Ʒ��ij��ȤС�����Ʊ���������ƾ���(Na2S2O3��5H2O)��
����[��������]
��1��Na2S2O3��5H2O����ɫ�����壬������ˮ����ϡ��Һ��BaCl2��Һ����������ɡ�
��2����Na2CO3��Na2S���Һ��ͨ��SO2���Ƶ�Na2S2O3�����ò�Ʒ�г���������Na2SO3��Na2SO4��
��3��Na2SO3�ױ�������BaSO3������ˮ��������ϡHCl��
��4�������������ⷴӦ�����ӷ���ʽΪ��2S2O32-+I2=S4O62-+2I-
����[�Ʊ���Ʒ]ʵ��װ����ͼ��ʾ(ʡ�Լг�װ��)

ʵ�鲽�裺
��1������ͼ��ʾ��װ��װ�ú�Ӧ��_______________(���������)���ٰ�ͼʾ�����Լ�������B��D��������____________________________��E�е��Լ���__________(ѡ��������ĸ���)��
A��ϡH2SO4 B��NaOH��Һ C������NaHSO3��Һ
��2��������ƿC�м���Na2S��Na2CO3�����Һ��������ƿA�еμ�ŨH2SO4��C�з�Ӧ����Na2S2O3��CO2����ѧ����ʽΪ______________________��
��3����Na2S��Na2CO3��ȫ���ĺ�����Ӧ������C�л��Һ����Һ���������ᾧ�����ˡ�ϴ�ӡ�����õ���Ʒ��
����[̽���뷴˼]
��1��Ϊ��֤��Ʒ�к���Na2SO3��Na2SO4����С�����������ʵ�鷽�����뽫��������������(�����Լ���ϡHNO3��ϡH2SO4��ϡHCl������ˮ��ѡ��)��
ȡ������Ʒ���ϡ��Һ���μ�����BaCl2��Һ���а�ɫ�������ɣ�____________��������δ��ȫ�ܽ⣬���д̼�����ζ��������������ȷ����Ʒ�к���Na2SO3��Na2SO4��
��2����I2�ı���Һ�ⶨ��Ʒ�Ĵ���
ȡ10.0g��Ʒ�����Ƴ�100mL��Һ��������Һ������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������__________��������̼��ȡ10.00mL��Һ����________��ҺΪָʾ������Ũ��Ϊ0.10mol/LI2�ı��ܲ����еζ���������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.95 | 17.10 | 20.05 |
�ζ�ʱ���ﵽ�ζ��յ��������___________________________________________��Na2S2O3��5H2O�ڲ�Ʒ�е�����������_______________(�ðٷ�����ʾ���ұ���1λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A. �Ʊ����ķ���ϩ�ĵ������ڲ�������
B. ����ʽΪC4H10O�Ĵ���4��ͬ���칹��
C. ����ϩ��![]() �����ӵ�����ԭ�Ӳ�������ͬһƽ����
�����ӵ�����ԭ�Ӳ�������ͬһƽ����
D. �춡ϩ���ױ�����ʹ��ˮ��ɫ������ɫԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У������Ϣ�A��Ԫ�������������ǣ� ��
A.���ϵ���ԭ�Ӱ뾶��С
B.���γɩ�1������
C.����������ˮ����������
D.���ϵ����⻯����ȶ������μ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com