
【题目】建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) H2=-574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) H3=-1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是 ___ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)N2(g)+2CO2(g) H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
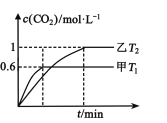
①甲容器中,平衡时NO2的转化率为____;
②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____;
③T2温度时,该反应的平衡常数K=____;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。
(3)方案3:可以利用原电池原理处理氮氧化合物,原理如图。则其正极的电极反应式为____。

【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=799kJ/mol ![]() > < 温度升高,c(CO2)低,平衡逆向移动,正反应为放热反应 16 = 2NO+4e-+4H+=N2+2H2O
> < 温度升高,c(CO2)低,平衡逆向移动,正反应为放热反应 16 = 2NO+4e-+4H+=N2+2H2O
【解析】
(1)甲烷完全燃烧的化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l),
根据①N2(g)+O2(g)=2NO(g) △H=+180.5kJmol1;
②CH4(g)+4NO2(g)=4NO(g)+4CO2(g)+2H2O(1) △H=574kJmol1;
③CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1) △H=1160kJmol1;
根据盖斯定律①×2+③可得,CH4(g)+2O2(g)=CO2(g)+2H2O(l)的焓变△H=+180.5kJmol1×2+(1160kJmol1)=799kJ/mol,热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=799kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=799kJ/mol;
(2)①根据三段式:
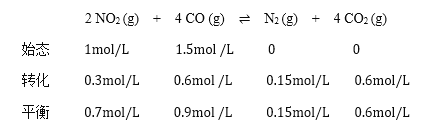
则平衡时NO2的转化率为![]() ,故答案为:
,故答案为:![]() 。
。
②根据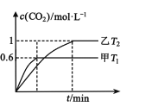 分析可知,T1时先达到平衡,速率快,T1>T2,温度升高,c(CO2)低,平衡逆向移动,该反应的正反应为放热反应,故答案为:>;<;温度升高,c(CO2)低,平衡逆向移动,正反应为放热反应。
分析可知,T1时先达到平衡,速率快,T1>T2,温度升高,c(CO2)低,平衡逆向移动,该反应的正反应为放热反应,故答案为:>;<;温度升高,c(CO2)低,平衡逆向移动,正反应为放热反应。
③根据三段式:
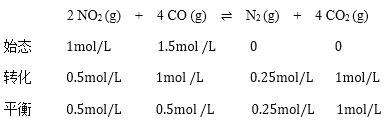
该反应的平衡常数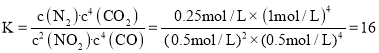 ,故答案为:16。
,故答案为:16。
④乙容器达到平衡后,再充入1.5mol/LNO2和1mol/LCO2,则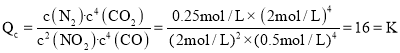 ,则反应仍是平衡状态,v(正)=v(逆),故答案为:=。
,则反应仍是平衡状态,v(正)=v(逆),故答案为:=。
(3)根据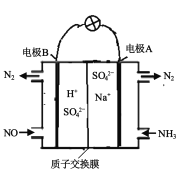 可知,电极A上发生氧化反应,为负极,电极B上发生还原反应,为正极,电解质溶液为酸性溶液,则正极的电极反应式为:2NO+4e-+4H+=N2+2H2O,故答案为:2NO+4e-+4H+=N2+2H2O。
可知,电极A上发生氧化反应,为负极,电极B上发生还原反应,为正极,电解质溶液为酸性溶液,则正极的电极反应式为:2NO+4e-+4H+=N2+2H2O,故答案为:2NO+4e-+4H+=N2+2H2O。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是![]()
A.洪涝、地震灾区灾后常用石灰对环境进行消毒,是利用石灰可使蛋白质变性的性质
B.食品添加剂对人体均有益,因此在添加时无需对其用量进行严格控制
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.根据分散系的稳定性,将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铜是一种铜镍合金,为我国首先发明使用并传入世界各地,其发明在世界化学史和冶金史中都占有重要地位。白铜广泛用于造船、石油、化工、建筑、电力、精密仪表、医疗器械、乐器制作等部门作耐蚀的结构件。
(1)镍元素基态原子的电子排布式为______________,3d能级上的未成对电子数为______。
(2)单质铜、镍都是通过__________ 键形成晶体;比较元素铜与镍的第二电离能大小,I2(Cu)_____I2(Ni) (填“>”或“<”),原因是______________________。
(3)金属镍粉在CO气流中轻微加热,生成无色(或黄色)易挥发的液体Ni(CO)4。 写出一种与Ni(CO)4的配体互为等电子体的物质的分子式_____ ;推测Ni(CO)4的晶体类型是_______。呈正四面体构型的Ni( CO)4。易溶于下列物质中的______(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为______该化合物的摩尔质量为M g●mol-1, NA代表阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是_____g .cm-3。
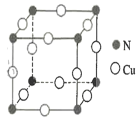
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B. 常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
C. 将0.2 mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA
D. 50 mL12 mol/L盐酸与足量MnO2共热,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是_____→____(填化学式)。
②该反应的氧化产物是________(填化学式)。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____。
(3)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
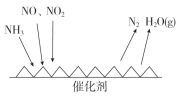
①由上图可知SCR技术中的氧化剂为_____________。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束后发现试管a中的物质分为3层。对实验的分析错误的是( )
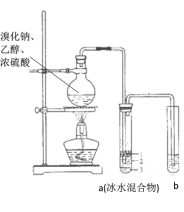
A.溴乙烷在a中第一层
B.a中有产物和水还含有HBr、CH3CH2OH等
C.b中盛放的酸性KMnO4会变色
D.烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。完成下列填空:
(1) 实验室配制氯化铝溶液时加入盐酸的目的是____________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是______(填编号)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6-n),为确定n的值,取3.490g白色固体,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等价,进行如下实验:
(3)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g。判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧_______次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定A12O3的质量的原因可能是____(选填编号)。
a 干燥Al(OH)3固体时易失水 b Al2O3的质量比Al(OH)3大,误差小
c 沉淀Al(OH)3时不完全 d 灼烧氧化铝时不分解
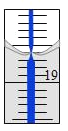
(4)从另一份溶液中取出20.00 mL,用0.1290 mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数__________mL,Al2(OH)nCl(6-n)中n的值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液的pH通常在7.35-7.45之间的原因是血液中存在NaH2PO4-Na2HPO4等缓冲体系。常温下:Ka1(H3PO4)=7.6×10-3、Ka2(H3PO4)=6.3×10-8。下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1mol/L NaH2PO4溶液:2c(HPO42-)+3c(PO43-)>c(Na+)-c(H2PO4-)
B.常温下,pH=7的NaH2PO4和Na2HPO4的混合溶液:c(Na+)>c(HPO42-)>c(H2PO4-)
C.向10 mL0.1mol/L NaH2PO4溶液中加入5mL 0.4 mol/L NaOH溶液:c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)
D.物质的量浓度相等NaH2PO4和Na2HPO4溶液等体积混合:3[c(H2PO4-)+c(HPO42-)+c(PO43-)]=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用绿柱石(主要成分3BeOAl2O36SiO2,还含有铁元素)冶炼铍,其简化的工艺流程如图所示:
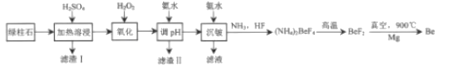
已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
Be2+ | Al3+ | Fe3+ | Fe2+ | |
开始沉淀时 | 5.2 | 3.3 | 1.5 | 6.5 |
沉淀完全时 | 8.8 | 5.0 | 3.7 | 9.7 |
回答下列问题:
(1)滤渣Ⅰ的主要成分是______,加入H2O2的作用是______。
(2)得到滤渣Ⅱ的合理pH范围是______。
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是______。
(4)得到(NH4)2BeF4的化学方程式为______。
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是______。
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为______。(用含a、b的表达式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com