
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是_____→____(填化学式)。
②该反应的氧化产物是________(填化学式)。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____。
(3)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
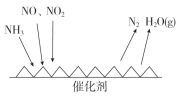
①由上图可知SCR技术中的氧化剂为_____________。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________。
【答案】HClO3 Cl2 O2 HClO4 2Mn2++5 IO4+3H2O=2MnO4+5 IO3+6H+ 2NH3+NO+NO2![]() 2N2+3H2O
2N2+3H2O
【解析】
(1)得电子的反应物是氧化剂,氧化剂在反应中发生还原反应,失电子的反应物是还原剂,还原剂对应的产物是氧化产物;
(2)锰离子失电子而转化为高锰酸根离子,所以锰离子作还原剂,则得电子化合价降低的物质作氧化剂,根据元素的化合价确定氧化剂和还原产物,再结合离子方程式的书写规则书写;
(3)①得电子,化合价降低的反应物是氧化剂;
②根据化合价升降总数相等、原子守恒来配平;
(1)①8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O中,氧化剂和还原剂都是HClO3,HClO3中Cl元素得电子化合价降低生成Cl2而发生还原反应,所以发生还原反应的过程是HClO3→Cl2;
故答案为:HClO3;Cl2;
②O氧元素的化合价由2价→0价,Cl元素的化合价由+5价→+7价,所以氧化产物是O2、HClO4;
故答案为:O2、HClO4;
(2)①锰离子失电子被氧化生成高锰酸根离子,所以锰离子作还原剂,氧化剂得电子化合价降低,IO3和IO4中碘元素的化合价分别是+5价和+7价,所以IO4作氧化剂,还原产物是IO3,同时水参加反应生成氢离子,所以该反应的离子方程式为:2Mn2++5 IO4+3H2O=2MnO4+5 IO3+6H+,
故答案为:2Mn2++5 IO4+3H2O=2MnO4+5 IO3+6H+;
(3)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2,
故答案为:NO、NO2;
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO+NO2![]() 2N2+3H2O,
2N2+3H2O,
故答案为:2NH3+NO+NO2![]() 2N2+3H2O;
2N2+3H2O;


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,表中列出了①~⑧元素。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
用元素符号或化学式填写下列空格:
(1)①~⑦元素中,原子半径最大的元素是_______(填元素符号),最高价氧化物对应水化物中酸性最强的物质是____________________(填酸的化学式)。
(2)①的气态氢化物的电子式为_________________。
(3)①~⑧元素中,③的氢氧化物的碱性______④的氢氧化物(“大于、小于或等于”);②的氢化物稳定性______⑦的氢化物(“大于、小于或等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不能用来解释相应实验现象的是
选项 | 实验现象 | 离子方程式 |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | Mg(OH)2+2NH4+ |
B | 向酸性KMnO4溶液中滴加草酸钠溶液,紫色溶液褪色 | 2MnO4-+5C2O42-+8H2O=2Mn2++10CO2↑+16OH- |
C | 将二氧化硫通入足量的Ba(NO3)2溶液中,产生白色沉淀和无色气体(遇空气变红棕色) | 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ |
D | 氢氧化铁溶于HI溶液中 | 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAI(SO4)212H2O]是一种重要的化工产品,在生产、生活中都有广泛的用途。
某工厂计划利用炼铝厂的废料铝灰(含Al、A12O3、少量SiO2和FeOxFe2O3)为原料生产明矾产品,设计的生产工艺流程如下:
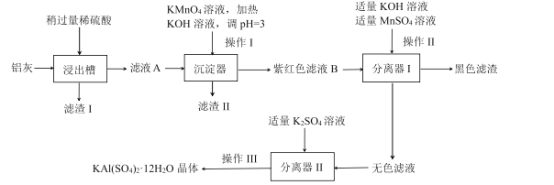
己知:![]()
请回答下列问题:
(1)检验滤液A中是否存在Fe2+,可用K3[Fe(CN)6]溶液,请写出其检验的离子反应方程式____。
(2)沉淀器中加入KMnO4溶液的作用是____;有人认为该生产流程较为复杂,可以用____溶液(填化学式)代替KMnO4溶液而使操作Ⅰ和操作Ⅱ过程得到优化。
(3)操作Ⅲ是 ___、____(填操作名称)、过滤、洗涤;在洗涤晶体时采用的洗涤剂最合适的是 ___(填正确答案标号)。
A.稀硫酸 B.蒸馏水 C.70%酒精
(4)明矾可作净水剂,其净水原理是 ____用离子方程式表示)。
(5)在沉淀器中调pH=3,请计算说明Fe3+是否完全沉淀(当Fe3+离子浓度小于或等于1.0x 10-5 mol/L时,可以认为溶液中无该离子)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确表示下列反应的离子反应方程式为
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:![]()
C.![]() 稀溶液与过量的KOH溶液反应:
稀溶液与过量的KOH溶液反应:![]()
D.醋酸除去水垢:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) H2=-574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) H3=-1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是 ___ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)N2(g)+2CO2(g) H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
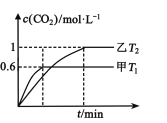
①甲容器中,平衡时NO2的转化率为____;
②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____;
③T2温度时,该反应的平衡常数K=____;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。
(3)方案3:可以利用原电池原理处理氮氧化合物,原理如图。则其正极的电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含C、H、O、N四种元素,其3D模型如图所示。下列有关该有机物的说法正确的是
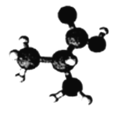
A.常温常压下呈气态B.分子式为C3H7O2N
C.与甘氨酸互为同分异构体D.分子中所有C、N原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2某化学兴趣小组设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2。完成下列填空:
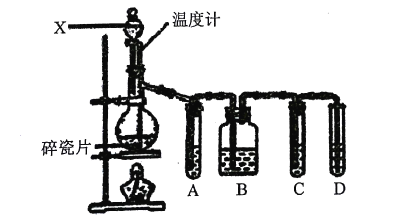
(1)装置中碎瓷片的作用是:___。
(2)仪器X的名称是___。
(3)写出生成乙烯的反应方程式:___,该反应的反应类型为:___。
(4)试管A、B、C、D中可盛放的试剂是(从下列试剂中选出,试剂可重复使用,填序号):
①品红溶液 ②NaOH溶液 ③溴水 ④稀硫酸
A___;B___;C___;D___。
(5)确证含有乙烯的现象是___。
(6)若没有试管A、B、C,则在试管D中所发生反应的化学方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:
主反应 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(乙醚的制备)
实验装置如图所示(夹持装置和加热装置略)

(1)仪器a是_____(写名称);仪器b应更换为下列的 ___(填字母)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为_____(填字母),取出乙醚后立即密闭保存。
a.组装实验仪器
b.加入12mL浓硫酸和少量乙醇的混合物
c.检查装置气密性
d.熄灭酒精灯
e.点燃酒精灯
f.通冷却水
g.控制滴加乙醇的速率与产物馏出的速率相等
h.弃去前馏分
i.拆除装置
(3)加热后发现仪器a中没有添加碎瓷片,处理方法是_____;若滴入乙醇的速率显著超过产物馏出的速率,则反应速率会降低,可能的原因是 ____。
(乙醚的提纯)
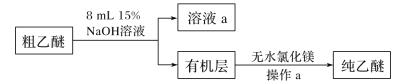
(4)用15%NaOH溶液洗涤粗乙醚的原因是____________;无水氯化镁的作用是_____。
(5)操作a的名称是____;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管接室外相同,均为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com