
【题目】下列离子方程式不能用来解释相应实验现象的是
选项 | 实验现象 | 离子方程式 |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | Mg(OH)2+2NH4+ |
B | 向酸性KMnO4溶液中滴加草酸钠溶液,紫色溶液褪色 | 2MnO4-+5C2O42-+8H2O=2Mn2++10CO2↑+16OH- |
C | 将二氧化硫通入足量的Ba(NO3)2溶液中,产生白色沉淀和无色气体(遇空气变红棕色) | 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ |
D | 氢氧化铁溶于HI溶液中 | 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
A.AB.BC.CD.D
【答案】B
【解析】
A. 铵根水解生成氢离子,氢氧化镁可以与氢离子发生反应使铵根的水解平衡右移,最终氢氧化镁溶解,铵根彻底水解,离子方程式为Mg(OH)2+2NH4+=Mg2++2NH3H2O,故A正确;
B. 酸性高锰酸钾溶液中不可能生成氢氧根,正确离子反应方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O,故B错误;
C. 二氧化硫溶于水显酸性,酸性环境中硝酸根会将二氧化硫氧化成硫酸根,继而生成硫酸钡沉淀,离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,故C正确;
D. 三价铁离子具有较强氧化性,会将碘离子氧化成碘单质,离子方程式为2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是
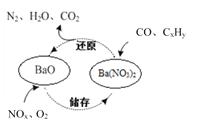
A. 在转化过程中,氮元素均被还原
B. 依据图示判断催化剂不参与储存和还原过程
C. 还原过程中生成0.1mol N2,转移电子数为0.5 mol
D. 三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 与
与![]() 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得![]() ;③打开K,通入
;③打开K,通入![]() 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出![]() ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
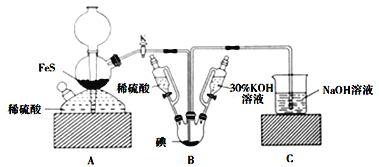
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为![]()
C.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
D.装置C中氢氧化钠溶液的作用是吸收硫化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻甲基苯甲酸主要用于农药、医药及有机化工原料的合成,其结构简式为 ,下列关于该物质的说法正确的是( )。
,下列关于该物质的说法正确的是( )。
A.该物质能与溴水生成白色沉淀
B.该物质含苯环的同分异构体中能水解且含有甲基的共5种
C.1mol该物质最多能与4molH2生加成反应
D.该物质中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
A.它与水反应的化学方程式为NH5 + H2O ═ NH3H2O + H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为 
D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铜是一种铜镍合金,为我国首先发明使用并传入世界各地,其发明在世界化学史和冶金史中都占有重要地位。白铜广泛用于造船、石油、化工、建筑、电力、精密仪表、医疗器械、乐器制作等部门作耐蚀的结构件。
(1)镍元素基态原子的电子排布式为______________,3d能级上的未成对电子数为______。
(2)单质铜、镍都是通过__________ 键形成晶体;比较元素铜与镍的第二电离能大小,I2(Cu)_____I2(Ni) (填“>”或“<”),原因是______________________。
(3)金属镍粉在CO气流中轻微加热,生成无色(或黄色)易挥发的液体Ni(CO)4。 写出一种与Ni(CO)4的配体互为等电子体的物质的分子式_____ ;推测Ni(CO)4的晶体类型是_______。呈正四面体构型的Ni( CO)4。易溶于下列物质中的______(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为______该化合物的摩尔质量为M g●mol-1, NA代表阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是_____g .cm-3。
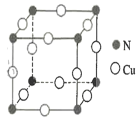
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列是中学化学中熟悉的物质:
O2 金刚石 NaBr H2SO4 Na2CO3 Na2S NaHSO4
回答下列问题:
这些物质中,只含共价键的是________;只含离子键的是________;既含离子键又含共价键的是________。
(2)写出下列物质的电子式。
Na2O2:_________________;
NH4H:_______________________;
(3)写出下列物质的结构式。
CO2:____________________
H2O2:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是_____→____(填化学式)。
②该反应的氧化产物是________(填化学式)。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____。
(3)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
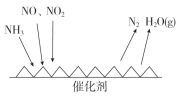
①由上图可知SCR技术中的氧化剂为_____________。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
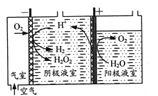
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
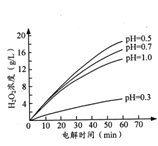
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
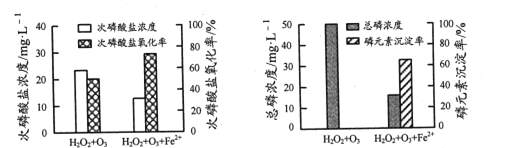
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com