
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
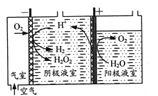
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
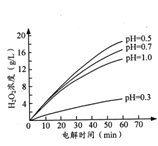
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
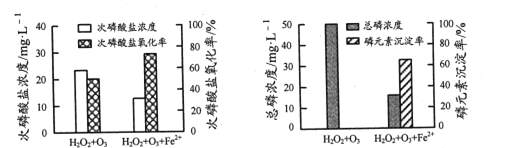
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
【答案】![]() c(H+)过小时,反应Ⅰ的化学反应速率较慢,c(H+)过大时,主要发生反应Ⅲ (a+b+c)kJ/mol Mn2+ 25L Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀
c(H+)过小时,反应Ⅰ的化学反应速率较慢,c(H+)过大时,主要发生反应Ⅲ (a+b+c)kJ/mol Mn2+ 25L Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀
【解析】
(1)由电解装置图可知阳极表面消耗水,产生氧气,以此写出电极方程式;
(2)由盖斯定律可得,①+②+③可得所求热化学方程式,中间产物Mn2+为催化剂;
(3)①弱碱性条件下OH将H2PO2-氧化成PO43-,反应为:![]() ,以此计算废水的体积;
,以此计算废水的体积;
②由图可知添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀。
(1)由电解装置图可知阳极表面消耗水,产生氧气,则电极方程式为![]() ,
,
故答案为:![]() ;
;
(2)已知:①H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
②H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
③·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
由盖斯定律可得,①+②+③可得所求热化学方程式![]() ,则△H=(a+b+c)kJ/mol, Mn2+为中间产物反应前后不发生改变为催化剂,
,则△H=(a+b+c)kJ/mol, Mn2+为中间产物反应前后不发生改变为催化剂,
故答案为:(a+b+c)kJ/mol;Mn2+;
(3)①弱碱性条件下·OH将H2PO2-氧化成PO43-,反应为:![]() , l.7g·OH物质的量
, l.7g·OH物质的量![]() ,则参与反应的H2PO2-物质的量为0.025mol,则废水的体积
,则参与反应的H2PO2-物质的量为0.025mol,则废水的体积![]() ,
,
故答案为:25L;
②由图可知添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀,
故答案为:Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知酸性:![]() > H2CO3>
> H2CO3>![]() >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 转变为
转变为 的最佳方法是
的最佳方法是
A. 与稀H2SO4共热后,加入足量的NaOH溶液
B. 与稀H2SO4共热后,加入足量的NaHCO3溶液
C. 与足量的NaOH溶液共热后,再通入足量CO2
D. 与足量的NaOH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是 ( )
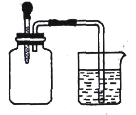
①H2、O2 ②Cl2、SO2
③NO2、O2 ④N2、H2
A.①②③B.②④
C.③④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点390℃,沸点430℃,易与水反应,可用锂与氨气加热反应制得。下面是实验室制备LiNH2时可能用到的装置图,回答下列问题:
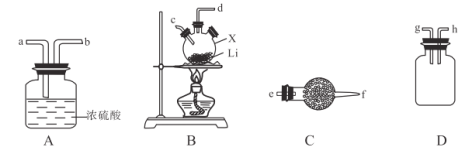
(1)仅从性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填字母)。
A.浓氨水、Ca(OH)2固体 B.浓氨水、CaO C.NH4Cl固体、Ca(OH)2固体
(2)选用(1)中适宜药品制取出的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处字母)。
(3)装置A的作用是_______________________。
(4)实验开始时,应先通入NH3后加热仪器X,原因是____________________。
(5)氨基锂能与水反应生成LiOH与一种气体,请设计实验证明制备的LiNH2中是否含有金属锂。_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋氨酸铜[Cux(Met)y,Met表示蛋氨酸根离子]是一种新型饲料添加剂。为确定蛋氨酸铜[Cux(Met)y]的组成,进行如下实验:
(1)称取一定质量的样品于锥形瓶中,加入适量的蒸馏水和稀盐酸,加热至全部溶解,冷却后将溶液分成两等份。
②取其中一份溶液,调节溶液pH在6~8之间。加入0.1000 mol/LI2的标准溶液25.00 mL,充分反应后滴入2~3滴指示剂X,用0.1000 mol/LNa2S2O3标准溶液滴定至蓝色恰好褪去,发生反应:![]() 。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
③向另一份溶液中加入NH3·H2O-NH4Cl缓冲溶液,加热至70℃左右,滴入2-3滴指示剂PAN,用0.02500 mol/LEDTA (Na2H2Y)标准溶液滴定其中Cu2+(离子方程式为Cu2++H2Y2--=CuY2-+2H+),消耗EDTA标准溶液28.00 mL。
(1)指示剂X为 ____。
(2)用Na2S2O3标准液滴定时,若pH过小,会有S和SO2生成。写出S2O32-与H+反应的离子方程式 ___________ 。
(3)若滴定管水洗后未用EDTA标准溶液润洗,测得Cu2+的物质的量将____(填“偏大”、“偏小”或“不变”)。
(4)通过计算确定蛋氨酸铜[Cux(Met)y]的化学式(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烯醛是一种重要的有机合成中间体,沸点为177℃,密度为0.848 g·cm-3,不溶于水。实验室采用正丁醛制各少量辛烯醛,反应原理为:
CH3CH2CH2CHO![]()

![]()
![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。

步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。
(l)步骤Ⅰ中的反应需在80℃条件下进行,适宜的加热方式为___ 。使用冷凝管的目的是 _______。
(2)步骤Ⅱ中所用仪器的名称为_____ 。碱液在仪器中处于_____(填“上层”或“下层”),如何判断有机相已经洗至中性:______。
(3)步骤Ⅲ中加入无水硫酸钠固体的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,请回答下列有关问题:
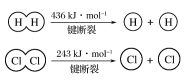
①由H+H→H2,当形成1 mol H—H键时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl—Cl键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
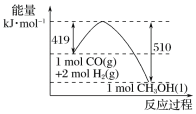
(2)①根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”) ________kJ能量。
②1mol CO(g)的总键能_______(填“>”、“=”或“<”)1mol CH3OH(l)的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1,2-二溴乙烷,下列制备方案中最好的是( )
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com