
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g).达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为( )
A.9
B.16
C.20
D.25
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷(g)和反-1,2-二甲基环丙烧(g) 可发生如下转化:


该反应的速率方程可表示为: v(正)=k(正)c(順)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。1温度下,k(正)=0.006s-1 ,k(逆)=0.002s-1。下列说法错误的是
A. t1温度下,反应的平衡常数值K1=3
B. 该反应的活化能Ea(正)小于Ea(逆)
C. t2温度下,上图中表示顺式异构体的质量分数随时间变化的曲线为B曲线
D. 由上图信息可以确定温度t2小于t1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的微量元素的说法,不正确的是 ( )
A.Cu、Zn、Mo等是细胞内的微量元素
B.微量元素是在生物体中可以有、也可以没有的一些元素
C.微量元素是维持正常生命活动不可缺少的元素
D.微量元素是指生物生活所必需的,但需要量却很少的一些元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。根据判断出的元素回答问题:

(1)y在元素周期表的位置是_____。
(2)比较g、h的气态氢化物的还原性强弱是:_____>_____。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式_____。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1molL‐1R溶液的烧杯中滴加1molL‐1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①写出m点反应的离子方程式_____。
②若R溶液改加20mL1.2 molL‐1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.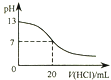
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.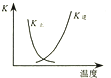
图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C.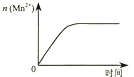
图③表示10 mL 0.01 molL﹣1 KMnO4 酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.
图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年7月23日,北京八达岭野生动物园东北虎园内,发生一起老虎伤人事件,可谓震惊异常。东北虎是陆地上最强大的食肉动物之一,当其捕食动物后,从动物体中获得化合物和元素,那么,东北虎和其所捕食动物体内的各种化学元素 ( )
A.种类差异很大,含量大体相同 B.种类和含量差异都很大
C.种类和含量都是大体相同的 D.种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸
![]()
请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境
(2)若A在常温下为气体,C是红棕色气体。①A和C的化学式分别是:A ;C
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M 为原子序数依次增大的短周期主族元素。已知:①元素对应的原子半径大小为:X<Z<Y<M<W;② Y 是组成有机物的必要元素 ③ Z 与 X 可形成两种常见的共价化合物,与 W 可形成两种常见的离子化台物;④ M 的电子层数与最外层电子数相等。下列说法不正确的是
A. W、M 的原子半径为 M<W
B. YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键
C. Z 与 X 形成的化合物的熔沸点偏高是因其分子内存在氢键
D. Z 与 M 形成的化合物可作为耐高温材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com