
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【答案】C
【解析】根据甲
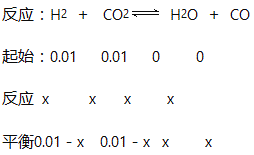
![]() ,x=0.006,平衡时,甲中CO2的转化率等于60%;乙和甲对比,乙相当于在甲的基础上增加了氢气的量,所以乙中二氧化碳的转化率增大,乙中二氧化碳的转化率大于60%,故A正确;甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,物质的转化率不变,甲中和丙中H2的转化率均是60%,故B正确;甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,丙的初始投入量是甲的2倍,所以平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol/L,故C错误;反应开始时,丙中的物质的浓度最大,反应速率最快,甲中的物质的浓度最小,反应速率最慢,故D正确;
,x=0.006,平衡时,甲中CO2的转化率等于60%;乙和甲对比,乙相当于在甲的基础上增加了氢气的量,所以乙中二氧化碳的转化率增大,乙中二氧化碳的转化率大于60%,故A正确;甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,物质的转化率不变,甲中和丙中H2的转化率均是60%,故B正确;甲和丙对比,相当于是在甲的基础上又加倍增大了物质的加入量,但是对于化学反应前后体积不变的反应,增大压强,化学平衡不移动,丙的初始投入量是甲的2倍,所以平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol/L,故C错误;反应开始时,丙中的物质的浓度最大,反应速率最快,甲中的物质的浓度最小,反应速率最慢,故D正确;


科目:高中化学 来源: 题型:
【题目】我国研究锂硫电池获得突破,电池的总反应是16Li+S8 ![]() 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
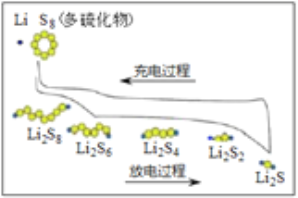
A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若某原子在处于能最最低状态时,外围电子排布为4d15s2,则下列说法正确的是___(填标号)
A.该元戴原子处于能量最低状态时,原子中共有3个未成对电子
B.该元载原子核外共有5个电子层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层其有3个电子
(2)下列说法正确的是_______(填标号)
A.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.H2O分子中两个O-H键的键角为180°
D.所有分子中都含有共价键
(3)根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为____(填标号)
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥及单线桥表示反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 电子转移情况。
双线桥________________________________________。
单线桥________________________________________。
该反应中氧化剂是:_______。若有4molHNO3参加反应,转移电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。下列说法正确的是

A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)> c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究型学习小组在老师指导下利用以下装置探究氯气与氨气之间的反应情况,其中A、F分别为氨气和氯气的制取发生装置,C为纯净干燥的氯气与干燥的氨气发生反应的装置。请回答下列有关问题:
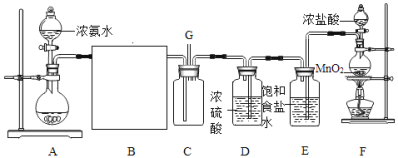
(1)实验室收集制备得到的氨气常用的方法是________________。
(2)请为B处虚线框内选择可能合适的装置以及相应的试剂名称__________(填序号)。
①球形干燥管装碱石灰 ②洗气瓶装浓硫酸 ③球形干燥管装氯化钙 ④球形干燥管装氢氧化钠
(3)装置F中发生反应的化学方程式为:_______________________________。若一定体积的浓盐酸中含有4mol HCl 溶质,则加热条件下与足量二氧化锰充分反应后,最终得到的氯气物质的量_______l mol(填>、<或=)。
(4)置D的作用是________________________,装置E的作用是除去HCl,使用饱和食盐水而不直接用蒸馏水的原因是__________________________________________________。
(5)氰(CN)2的化学性质与卤素单质如Cl2相似,请写出(CN)2与适量KOH溶液发生反应的化学方程式:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲酸二丁酯(DBP)是一种常见的塑化剂,可用乙烯和邻二甲苯为原料合成,合成过程如图所示:
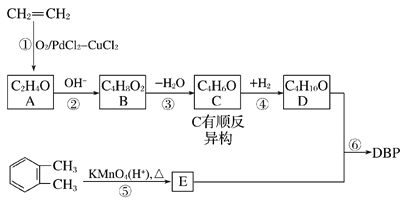
已知:I.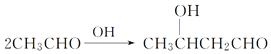 ;
;
II.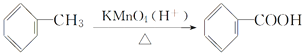 。
。
请回答下列问题:
(1)DBP的分子式为___,C的顺式结构简式为_________。
(2)B的结构简式为____,含有的官能团名称为_______。
(3)反应①属于____反应。
(4)E的一种同分异构体F,能与NaOH溶液反应,且l mol F完全反应消耗3 mol NaOH,写出F的三种可能结构简式____。
(5)检验C中含有碳碳双键的方法________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com