
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 | 现象 |
|
| |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
 |
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
答案:(15分,画图3分,其他每空2分)
(1)① 强氧化性 ② O2
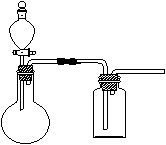 (2)Ⅰ①
(2)Ⅰ①
两处导气管进出长短对各1分,漏斗对1分)
② 2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O(物质1分,配平1分)
NaNO2 + NaNO3 + H2O(物质1分,配平1分)
Ⅱ① 2NO2 + 2C 点燃 N2 + 2CO2(物质1分,配平1分)
② 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧
中燃烧的实验。(按要求给分)
③ 主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体均存在。(按要求给分)
解析:(1)碳与浓硝酸的反应可联系实验现象,推测得到的是CO2、NO2、H2O,此过程中,浓硝酸体现出强氧化性。反应过程中浓硝酸受热分解:4HNO3 4NO2↑+O2↑+2H2O。
4NO2↑+O2↑+2H2O。
(2)实验室制取NO2可用Cu与浓硝酸反应,需固液不加热反应装置,又NO2密度比空气的大,且易与水反应,需用长进短出的向上排空气法收集;NO2有毒,多余的NO2可用NaOH溶液吸收,依题意发生反应:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O。
NaNO2 + NaNO3 + H2O。
Ⅱ.上述实验所得的气体中氧气浓度低于空气中氧气浓度,木炭在NO2气体中持续燃烧,火焰迅速变亮,说明NO2支持燃烧,不需要做木炭在纯氧中燃烧的对比试验。木炭被氧化,得到能使澄清石灰水变浑浊的CO2,NO2体现氧化性,N元素化合价降低,产生的气体遇空气不变色,可推测为N2,方程式为:2NO2 + 2C 点燃 N2 + 2CO2 。由题中实验可知,所得气体主要是NO2,也有O2,在此条件下,甲、乙同学的预测都有可能。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
下列表述或化学用语书写正确的是( )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:
Ba2++OH-+H++SO2- 4=BaSO4↓+H2O
B.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑
C.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
D.金属铝与氧化镁发生铝热反应:2Al+3MgO 高温 3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.只有在原子中,质子数才与核外电子数相等
B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分CuFeS2)除冶炼铜外,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为:
8CuFeS2+21O2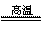 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 、 (填元素符号)。
⑵上述冶炼过程产生大量SO2 ,可选用下列试剂中的_____________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.用稀H2SO4浸泡炉渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____________(填离子符号),检验溶液中还存在Fe2+的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是
A.原子半径Z > Y
B.X 的最简单气态氢化物的热稳定性比Z的小
C.Y的最高价氧化物对应水化物的酸性比X 的弱
D.M的最高价氧化物对应水化物不能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和④ C.③和④ D.①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。某学生课外活动小组欲从海藻中提取碘(I2),设计如下的流程:(已知过程②中反应的离子方程式为:2I- + Cl2 = 2Cl- + I2。)
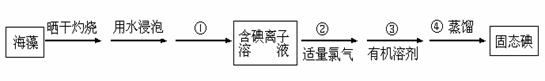 (1)指出提取碘的过程中有关步骤的实验操作的名称:① ③ ;
(1)指出提取碘的过程中有关步骤的实验操作的名称:① ③ ;
(2)提取碘的过程中,可选择的有机溶剂是 (填字母)。
A. 酒精 B. 水 C. 四氯化碳 D.醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com