
【题目】有关物质的转化关系如下图所示。常温下,B、E呈气态,其中B呈黄绿色。D是最常见的无色液体,E常用作制冷剂,F是一种不溶于水的碱,G是厨房中的常见调味品,H由两种元素组成,其摩尔质量为32 g·mol-1。

(1) E的电子式为____。
(2) H的化学式为____。
(3) 写出反应①的离子方程式:_________________。
(4) 写出反应②的化学方程式:_________________。
【答案】 ![]() N2H4 Cl2+2OH-
N2H4 Cl2+2OH-![]() Cl-+ClO-+H2O Mg3N2+6H2O
Cl-+ClO-+H2O Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
【解析】B呈黄绿色则为氯气,D是最常见的无色液体,D为水。结合流程可知E常用作制冷剂,由氮化镁与水反应生成,则E为氨气,F是一种不溶于水的碱,F为氢氧化镁;G是厨房中的常见调味品,G为氯化钠;A为氢氧化钠,氢氧化钠与氯气反应生成氯化钠G、次氯酸钠C和水D,次氯化钠与氨气反应生成氯化钠、水和H,H由两种元素组成,其摩尔质量为32 g·mol-1,则H为N2H4;故(1) E为氨气,电子式为![]() ;(2) H的化学式为N2H4;(3) 反应①是氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为: Cl2+2OH-
;(2) H的化学式为N2H4;(3) 反应①是氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为: Cl2+2OH-![]() Cl-+ClO-+H2O;(4) 反应②是氮化镁与水反应生成氨气和氢氧化镁,反应的化学方程式为: Mg3N2+6H2O
Cl-+ClO-+H2O;(4) 反应②是氮化镁与水反应生成氨气和氢氧化镁,反应的化学方程式为: Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑。
3Mg(OH)2+2NH3↑。


科目:高中化学 来源: 题型:
【题目】结晶玫瑰和高分子树脂M的合成路线如图所示:
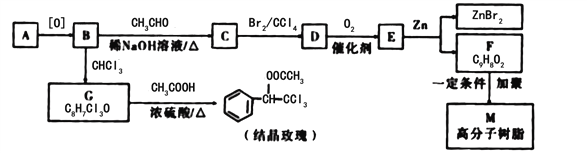
已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46
②![]()
③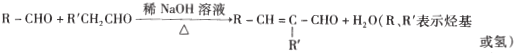
④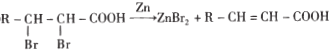
(1)C中含氧官能团的名称为______,E的结构简式为_____。
(2)写出由G生成结晶玫瑰的化学方程式________________________________。
(3)在上述流程中“C→D”在M的合成过程中的作用是___________________________
(4)己知G在一定条件下水解生成![]() ,写出H满足下列条件的同分异构体的结构简式______________________________
,写出H满足下列条件的同分异构体的结构简式______________________________
a与氯化铁溶液发生显色反应
b苯环上的一氯取代物只有一种
c与足量的氢氧化钠溶液反应,![]() 可消耗
可消耗![]() NaOH
NaOH
(5)E的同分异构体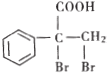 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_______________.
为原料设计它的合成路线(其他所需原料自选)_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
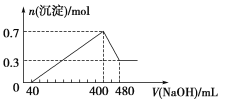
计算:
(1)合金中Mg的质量为________g;
(2)硫酸的物质的量浓度为________ mol·L1;
(3)NaOH溶液的物质的量浓度为________ mol·L1;
(4)生成H2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤造成的S2的大量排放已经给我们的生存环境造成了严重破坏,科学研究发现:一定条件下,通过下列反应可实现燃煤烟气中硫的回收。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g) ![]() 2CO2(g)十S(l) △H=________ kJ/mol
2CO2(g)十S(l) △H=________ kJ/mol
(2)燃煤烟气中硫的回收反应的平衡常数表达式K=_________。在温度和容积不变时,下列说法正确的是_________ (填字母序号)
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是_________(填字母序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mo1/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为_____________;
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为_______________;总反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1) 2017年10月22日,沪通长江大桥天生港航道桥主拱结构成功合龙。
①桥墩建造需要用到大量水泥。生产水泥的主要原料为黏土和____(填字母)。
a. 纯碱 b. 石灰石 c. 食盐

②氯丁橡胶作为桥梁支座,其作用是将桥跨结构上的荷载传递给墩台。氯丁橡胶属于____(填字母)。
a. 无机非金属材料
b. 金属材料
c. 有机高分子材料
③桥梁建造需要使用大量钢材,其中预埋钢板及上、下钢板均采用镀锌钢板,钢板镀锌的主要目的是____(填字母)。
a. 美化桥梁 b. 提高硬度 c. 提高耐腐蚀性
(2)洋蓟被人们冠以“蔬菜之皇”的美称,含有脂肪、蛋白质、糖类、维生素A、维生素C和丰富的钙、磷、铁等元素,其中:

①属于脂溶性维生素的是____。
②属于人体所需微量元素的是____。
③脂肪在人体内水解生成高级脂肪酸和____;糖类在人体中水解生成葡萄糖,写出葡萄糖在人体内氧化的化学方程式: ____。
(3)合理利用自然资源,防止环境污染和生态破坏。
①向燃煤中加入适量石灰石,可大大减少______的排放。煤的气化是实现能源清洁化的重要途径,水煤气的主要成分是CO和______。
②明矾是一种常用的混凝剂,其净水原理是___________(用离子方程式表示)。
③我国科学家证明了黄粉虫的幼虫可降解聚苯乙烯(![]() )这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:________________。防治废塑料制品造成的白色污染,还可以采用的方法有:__________(任写一种)。
)这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:________________。防治废塑料制品造成的白色污染,还可以采用的方法有:__________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有1mL 0.01 mol/L | 证明在相同温度下的 Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
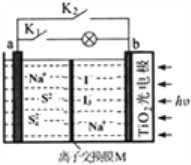
A. 关闭K2打开K1时,该装置实现太阳能转化为电能,又转化为化学能
B. M是阳离子交换膜.
C. 充电时,阳极的电极反应式为:3I--2e-=I3-
D. 放电时,b极区总离子浓度减小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用游离态的氮经一系列转化可制得硝酸,如下图所示。

(1)氨与氧气生成一氧化氮反应的化学方程式是______________。
(2)在800℃时,向容积为1L的密闭容器中充入0.020 mol NO和0.010 mol O2,发生反应2NO(g)+O2(g)![]() 2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。
2NO2(g),反应过程中O2的浓度随时间变化情况如下图所示。

①2min时,c(NO2)=_________mol/L。
②800℃时,该反应的化学平衡常数数值是__________。
③已知:

NO生成NO2热化学方程式是_________。为了提高NO的转化率可以采取的措施有__________。
(3)可用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。电解过程中NO转化为硝酸的电极反应式是__________。若处理标准状况下448 L的NO,则可得到质量分数为63%的HNO3溶液的质量是____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com