
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA
B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA
C.含7.8gNa2S的溶液中阴离子总数大于0.1NA
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA
【答案】D
【解析】
A. 标准状况下,5.6L甲烷和乙烯的混合气体的物质的量![]() ,而无论是甲烷还是乙烯中,一个分子所含碳氢键数都为4个,故0.25mol混合气体无论比例如何,所含碳氢键数均为NA,A正确;
,而无论是甲烷还是乙烯中,一个分子所含碳氢键数都为4个,故0.25mol混合气体无论比例如何,所含碳氢键数均为NA,A正确;
B. 足量镁与一定体积的浓硫酸反应时,由于镁足量,硫酸要反应完,产生气体为二氧化硫和氢气的混合气体,体积为2.24L(标准状况),总物质的量为0.1mol,产生二氧化硫时,硫由+6价变为+4价,生成1mol二氧化硫转移2mol电子,产生氢气是,2mol氢离子产生1mol氢气,转移电子仍为2mol,即转移电子的物质的量为气体的2倍,故生成0.1mol混合气体,转移的电子数为0.2NA,B正确;
C. 7.8gNa2S的物质的量![]() ,S2-总数为0.1NA ,而在水溶液中,S2-水解产生HS-和OH-,溶液中阴离子总数变多,所以大于0.1NA,C正确;
,S2-总数为0.1NA ,而在水溶液中,S2-水解产生HS-和OH-,溶液中阴离子总数变多,所以大于0.1NA,C正确;
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液时,开始时,稀盐酸过量,立即有二氧化碳放出,根据物料守恒,混合液中:N(CO32-)+N(HCO3-)+N(H2CO3)<0.1NA,D错误。
答案选D。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】33.6g 含杂质的Na2CO3、NaHCO3均匀混合物平均分成两份,向一份中加入250ml 1.00mol·L-1过量盐酸反应,生成标准状况下3.36L气体。将另一份充分灼烧,干燥后称得固体质量为13.7g。杂质不与酸反应,受热也不分解。求:
(1)原混合物中含有Na2CO3的物质的量。
(2)Na2CO3、NaHCO3的质量比。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种高效除草剂,其合成路线流程图如图:
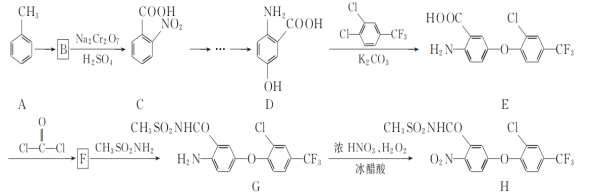
(1)E中含氧官能团名称为____和____。
(2)A→B的反应类型为____。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式:____。
①不能发生水解反应,能与FeCl3溶液发生显色反应:
②分子中有4种不同化学环境的氢。
(4)F的分子式为C15H7ClF3NO4(含六元杂环),写出F的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含FeCO3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如图:
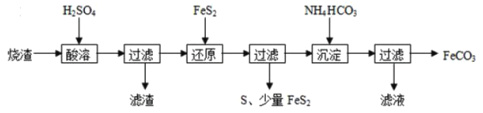
(1)“酸溶”时加快反应速率的方法有____(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___。
②FeS2还原后,检验Fe3+是否反应完全的方法是___。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②能否将NH4HCO3换成(NH4)2CO3___。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g,则Fe2O3的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4L SO3所含的氧原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
B.氯气与水反应:Cl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主知识产权的首套煤基乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
副反应:CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OHCH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)2CH3COOCH3(g)+2H2(g)![]() CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
(2)下列条件,有利于提高C2H5OH平衡产率的是___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)在1L密闭容器中充入1mol乙酸甲酯,乙酸甲酯的平衡转化率与温度和氢酯比(x)[x=![]() ]的关系如图1。
]的关系如图1。
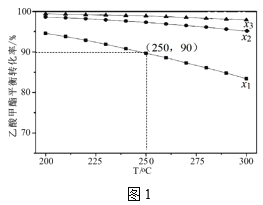
①x1、x2、x3的大小关系为___。
②250℃、x1=10,C2H5OH的选择性为60%,则主反应的平衡常数为___(保留2位有效数字)。(如乙醇选择性=![]() )
)
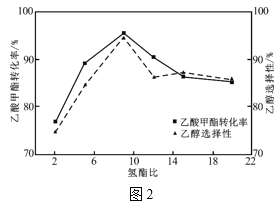
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图2所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___。
(5)若仅发生主反应,在恒压条件下,充入乙酸甲酯和氢气各2mol一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图3中画出t1~t3的正逆反应速率变化的示意图。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验所选择的装置或仪器(夹持装置已略去)不能达到实验目的的是( )
A.利用图装置制备并收集乙酸乙酯
B.利用图装置探究SO2的氧化性和漂白性
C.利用图装置收集氨气并进行尾气吸收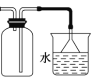
D.利用图装置从苯和溴苯的混合溶液中分离出溴苯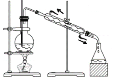
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com