
【题目】化合物H是一种高效除草剂,其合成路线流程图如图:
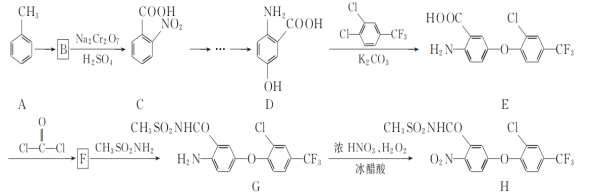
(1)E中含氧官能团名称为____和____。
(2)A→B的反应类型为____。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式:____。
①不能发生水解反应,能与FeCl3溶液发生显色反应:
②分子中有4种不同化学环境的氢。
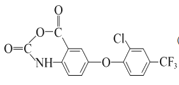
(4)F的分子式为C15H7ClF3NO4(含六元杂环),写出F的结构简式:___。
【答案】醚键 羧基 取代反应 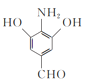 或
或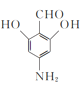 或
或![]()
【解析】
(1)根据E的结构简式可知E中含氧官能团名称为羧基和醚键,故答案为醚键和羧基;
(2)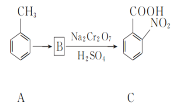 分析前后之间的结构,A→B应该是加了一个硝基,B→C应该是氧化变为了羧基,因此A→B的反应类型为取代反应,故答案为取代;
分析前后之间的结构,A→B应该是加了一个硝基,B→C应该是氧化变为了羧基,因此A→B的反应类型为取代反应,故答案为取代;
(3)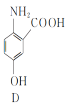 D的结构分析,再根据满足2个条件,①不能发生水解反应,说明没有酯基和肽键,能与FeCl3溶液发生显色反应,说明含有酚羟基,②分子中有4种不同化学环境的氢。如果按照现有三个基团来分析,三个基团本身有三种不同环境的氢,又不对称性,因此要想另外的基团来分析,分析可能两个—OH,一个—CHO,一个—NH2,因此写出
D的结构分析,再根据满足2个条件,①不能发生水解反应,说明没有酯基和肽键,能与FeCl3溶液发生显色反应,说明含有酚羟基,②分子中有4种不同化学环境的氢。如果按照现有三个基团来分析,三个基团本身有三种不同环境的氢,又不对称性,因此要想另外的基团来分析,分析可能两个—OH,一个—CHO,一个—NH2,因此写出 或
或 或
或![]() ,故答案为
,故答案为 或
或 或
或![]() 。
。
(4)F的分子式为C15H7ClF3NO4(含六元杂环),分析前后的物质,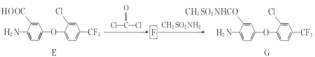 ,
,![]() 断两个C—Cl键,—COOH断O—H键和断—NH2中的N—H键,因此得到
断两个C—Cl键,—COOH断O—H键和断—NH2中的N—H键,因此得到 ,故答案为
,故答案为 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示。下列说法中,不正确的是( )

A. 工业合成氨属于人工固氮
B. 雷电作用下N2与O2发生化学反应
C. 在氮循环过程中不涉及氧化还原反应
D. 含氮无机物与含氮有机化合物可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:

已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4)![]() 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。

A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的镁-氮二次电池,其装置如图所示,下列说法不正确的是( )
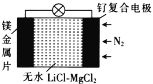
A.固氮时,电池的总反应为3Mg+N2=Mg3N2
B.脱氮时,钌复合电极的电极反应式为Mg3N2-6e-=3Mg2++N2
C.固氮时,外电路中电子由钌复合电极流向镁电极
D.当无水LiCl—MgCl2混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体。其合成路线如下:

(1)B中含氧官能团名称为________和________。
(2)B→C反应类型为________。
(3)D的分子式为C10H11OCl,写出D的结构简式:________。
(4)写出满足下列条件的F的一种同分异构体的结构简式:________。
①分子中含有1个苯环,能发生银镜反应;
②分子中有4种不同化学环境的氢。
(5)请以![]() 、
、![]() 和
和![]() 为原料制备
为原料制备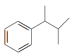 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Fe、Cl是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是___(填化学式)。
(2)焰色反应的实验中,Na元素的焰色为___色,观察K元素的焰色需要透过___。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___。
(4)MgO与碳粉和氯气在一定条件下反应可制备MgCl2,该反应的化学方程式为___。若尾气可用足量NaOH溶液完全吸收,则生成的盐为___(写化学式,只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA
B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA
C.含7.8gNa2S的溶液中阴离子总数大于0.1NA
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究利用如图装置对天然气进行脱硫,将硫由化合态转化成游离态,减少对环境的污染。已知甲、乙池中发生的反应如图所示。下列说法正确的是( )
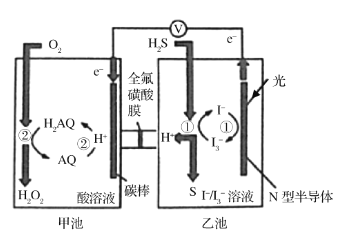
A.全氟磺酸膜为阳离子交换膜,H+从甲池移向乙池,乙池溶液的pH变小
B.电路中每转移2mol电子,甲池溶液质量增加32g
C.N型半导体为负极,发生的电极反应式为H2S+I3-=3I-+S↓+2H+
D.甲池中碳棒上发生的电极反应为AQ+2H++2e-=H2AQ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com