
【题目】在a、b、c、d四个集气瓶中分别盛有H2、Cl2、HCl、HBr中的任一种气体,若将a和d两瓶气体混合后见光爆炸;若将a和b两瓶气体混合后,瓶壁上出现暗红色液滴,则a、b、c、d四个集气瓶中分别盛放的气体是( )
A.Cl2、H2、HCl、HBr B.Cl2、HCl、HBr、H2
C.Cl2、HBr、H2、HCl D.Cl2、HBr、HCl、H2
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:

回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐是______(填他学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4_____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为______。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸人一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。则K2FeO4酸化时发生反应的离子方程式为_________;K2FeO4作为净水剂的优点除铁无毒外还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一无色透明的溶液做如下实验:
(1)取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
(2)另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
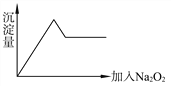
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32--、K+、SO42--等离子中一定存在的离子是_________________;可能存在的离子是_____________;一定不存在的离子是_____________________。
(2)上述溶液至少由___________________等物质混合成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代以石油为基础的三大合成材料是( )
①合成氨 ②塑料 ③医药 ④合成橡胶 ⑤合成尿素 ⑥合成纤维 ⑦合成洗涤剂.
A. ②④⑥ B. ②④⑦ C. ①③⑤ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
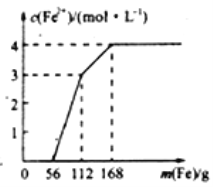
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
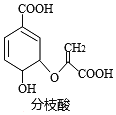
A. 分子中含有2种官能团
B. 1mol分枝酸最多可与3molNaOH发生中和反应
C. 可与乙醇、乙酸反应,且反应类型相同
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.HA电离出的c(H+)与水电离出的c(H+)之比为108
B.升高温度,溶液的pH减小
C.溶液的pH=4
D.HA的电离平衡常数约为l×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成![]() ,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )
,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )
A. Na2S2O3只有还原性
B. 氧化产物与还原产物的物质的量之比为2∶1
C. 每生成1 mol Na2S2O3,转移4×6.02×1023个电子
D. 标准状况下,每吸收4 mol SO2就会放出22.4 L CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com