
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、未用标准液润洗用蒸馏水洗过的碱式滴定管 |
| B、达到滴定终点,读数时俯视滴定管的刻度 |
| C、滴定过程中振荡锥形瓶有少许盐酸溅出 |
| D、盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
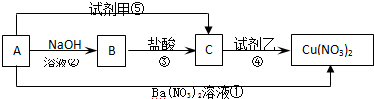
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重金属离子对人体有毒,常采用沉淀反应将之除去 |
| B、化肥中含有植物营养素,可大量使用以改善水环境 |
| C、轧钢厂排出的含盐酸的废水,可用熟石灰中和处理 |
| D、天然水中的细小悬浮颗粒,可用明矾等混凝剂净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 I--2e-=I2 碘遇淀粉变蓝 |
| B、Cu-2e-=Cu2+ Cu2+ 显蓝色 |
| C、2Cu+4I--4e-=2CuI↓+I2 碘遇淀粉变蓝 |
| D、4OH--4e-=2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 操作 |
| A | 配制80mL 1.0mol?L-1CuSO4溶液 | 将25g CuSO4?5H2O溶于蒸馏水配制成100mL溶液 |
| B | 除去KCl中少量KClO3 | 将混合物(加少量MnO2)置于坩埚中灼烧至固体质量不再减少 |
| C | 在溶液中将MnO4- 完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯(甲苯):加酸性KMnO4溶液,振荡后分液 |
| B、甲烷(乙烯):通过盛有溴水的洗气瓶 |
| C、乙醇(丙三醇):用分液漏斗分液 |
| D、苯(苯酚):加浓溴水,后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
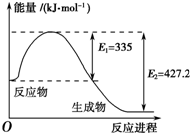 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| 化学键 | H-H | N-H | N≡N |
| 键能kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com