
| A、重金属离子对人体有毒,常采用沉淀反应将之除去 |
| B、化肥中含有植物营养素,可大量使用以改善水环境 |
| C、轧钢厂排出的含盐酸的废水,可用熟石灰中和处理 |
| D、天然水中的细小悬浮颗粒,可用明矾等混凝剂净化 |


科目:高中化学 来源: 题型:
| A、碘化亚铁溶于稀硝酸中:3Fe2++4H++NO3-=3Fe3++NO↑+2 H2O | ||||
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | ||||
C、向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液成红褐色:Fe3++3H2O
| ||||
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
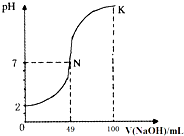 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
 为碳原子,
为碳原子, 为硅原子).每个碳原子周围与其距离最近的硅原子有
为硅原子).每个碳原子周围与其距离最近的硅原子有查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②⑥ | C、② | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+和SO42-恰好完全反应 |
| B、出现白色沉淀 |
| C、混和液中c(Cl-)>c(Na+) |
| D、混和液中c(Na+)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com