
ЎҫМвДҝЎҝXЎўYЎўZЎўRЎўWКЗФӯЧУРтКэТАҙОөЭФцөДОеЦЦ¶МЦЬЖЪЦчЧеФӘЛШЈ¬ЛьГЗЛщФЪЦЬЖЪКэЦ®әНОӘ11Ј¬ЖдЦРYФӘЛШЧоёЯУлЧоөН»ҜәПјЫөДҙъКэәНОӘ2Ј¬YәНZөДөҘЦКЙъіЙөД»ҜәПОпКЗТ»ЦЦҙ«өЭЙсҫӯРЕПўөДЎ°РЕК№·ЦЧУЎұЈ¬RөДФӯЧУ°лҫ¶КЗОеЦЦФӘЛШЦРЧоҙуөДЈ¬YәНWКЗН¬ЧеФӘЛШЎЈПВБРЛө·ЁҙнОуөДКЗЈЁ Ј©
A. јтөҘАлЧУөД»№ФӯРФЈәY>Z
B. RөДөҘЦКҝЙДЬКЗҪрКф»т·ЗҪрКф
C. УЙXЎўZәНW№№іЙөДЛбТ»¶ЁКЗИэФӘЛб
D. ұкЧјЧҙҝцПВЈ¬1molYZУл0.5mol![]() »мәПәуЛщөГЖшМеөДМе»эТ»¶ЁРЎУЪ22.4L
»мәПәуЛщөГЖшМеөДМе»эТ»¶ЁРЎУЪ22.4L
Ўҫҙр°ёЎҝC
ЎҫҪвОцЎҝ
YФӘЛШОӘNФӘЛШЈ¬WФӘЛШОӘPФӘЛШЈ¬Ў°РЕК№·ЦЧУЎұОӘNOЈ¬ФтZФӘЛШОӘOФӘЛШЈ»RөДФӯЧУ°лҫ¶КЗОеЦЦФӘЛШЦРЧоҙуөДЈ¬ЛщТФУҰОӘөЪИэЦЬЖЪөДNaЎўMgЎўAl»тSiЈ¬ФтXФӘЛШОӘHФӘЛШЎЈ
A. АлЧУ°лҫ¶ФҪҙуЈ¬ФҪТЧК§ИҘөзЧУЈ¬АлЧУ»№ФӯРФФҪЗҝЈ¬°лҫ¶Јә![]() Ј¬»№ФӯРФЈә
Ј¬»№ФӯРФЈә![]() Ј¬№КAХэИ·Ј»
Ј¬№КAХэИ·Ј»
B. RҝЙДЬОӘNaЎўMgЎўAl»тSiЈ¬КЗҪрКф»т·ЗҪрКфЈ¬№КBХэИ·Ј»
C. HЎўOЎўPТІҝЙДЬ№№іЙТ»ФӘЛб![]() өИЈ¬№КCҙнОуЈ»
өИЈ¬№КCҙнОуЈ»
D. УЙУЪ2![]() Ј¬ЛщТФ1mol NOУл0.5mol
Ј¬ЛщТФ1mol NOУл0.5mol![]() »мәПәуЛщөГЖшМеөДОпЦКөДБҝРЎУЪ1molЈ¬ЖдМе»эФЪұкЧјЧҙҝцПВТ»¶ЁРЎУЪ22.4LЈ¬№КDХэИ·Ј»
»мәПәуЛщөГЖшМеөДОпЦКөДБҝРЎУЪ1molЈ¬ЖдМе»эФЪұкЧјЧҙҝцПВТ»¶ЁРЎУЪ22.4LЈ¬№КDХэИ·Ј»
ҙр°ёСЎCЎЈ


 И«ДЬІвҝШЖЪД©РЎЧҙФӘПөБРҙр°ё
И«ДЬІвҝШЖЪД©РЎЧҙФӘПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝРВДЬФҙЖыіөөДәЛРДІҝјюКЗп®АлЧУөзіШЈ¬іЈУГБЧЛбСЗМъп®(LiFePO4)Чцөзј«ІДБПЎЈ¶ФLiFePO4·ПҫЙөзј«ЈЁә¬ФУЦКAlЎўКҜД«·ЫЈ©»ШКХІў»сөГёЯҙҝLi2CO3өД№ӨТөБчіМИзНјЈә
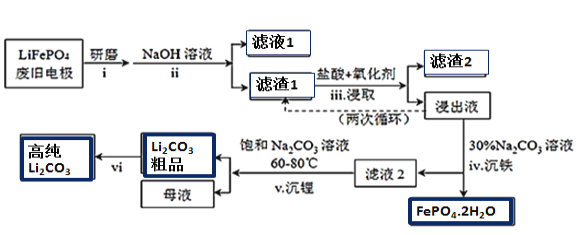
ЧКБПЈәМјЛбп®ФЪЛ®ЦРИЬҪв¶ИЛжОВ¶Иұд»ҜИзПВЈә
ОВ¶И/Ўж | 0 | 20 | 40 | 60 | 80 | 100 |
ИЬҪв¶И/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)№эіМiСРДҘ·ЫЛйөДДҝөДКЗ__________________ЎЈ
(2)№эіМiiјУИлЧгБҝNaOHИЬТәөДЧчУГ(УГ»ҜС§·ҙУҰ·ҪіМКҪұнКҫ)_________________ЎЈ
(3)Из№эіМiiiІЙУГNaClO3ЧчОӘСх»ҜјБЈ¬Фт№эіМЦР»б·ҙУҰ»б·ўЙъёұ·ҙУҰЙъіЙ»ЖВМЙ«ЖшМеЈ¬
ўЩёГёұ·ҙУҰ¶ФУҰөДАлЧУ·ҪіМКҪОӘ_______________________________________________________Ј»
ҙУ»·ұЈҪЗ¶И·ЦОцЈ¬СЎФс___________(МоЧЦДё)ЧчОӘёГ№эіМөДСх»ҜјБ»бёьәГЎЈ
a.H2O2 b.ЕЁБтЛб c.ЕЁHNO3
ўЪ№эіМiiiөГөҪөДҪюіцТәСӯ»·БҪҙОөДДҝөДКЗ________________________________________________ЎЈ
(4)ҪюіцТәЦРҙжФЪҙуБҝH2PO4©ҒәНHPO42-Ј¬ТСЦӘЈә![]() Ј¬ҪбәПЖҪәвТЖ¶ҜФӯАнЈ¬ҪвКН№эіМivөГөҪБЧЛбМъҫ§МеөДФӯТт______________________________________ЎЈ
Ј¬ҪбәПЖҪәвТЖ¶ҜФӯАнЈ¬ҪвКН№эіМivөГөҪБЧЛбМъҫ§МеөДФӯТт______________________________________ЎЈ
(5)јтКц№эіМviөДІЩЧч______________________________________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝұкЧјЧҙҝцПВЈ¬2 mol O2әН2 mol H2OПаұИҪПЈ¬ПВБРРрКцХэИ·өДКЗ
A.·ЦЧУКэПаөИB.Ме»эПаөИ
C.ЦКБҝПаөИD.ФӯЧУКэПаөИ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»о¶ҜРЎЧйАыУГ·ПМъРјЈЁә¬ЙЩБҝSөИФӘЛШЈ©ОӘФӯБПЦЖұёИэІЭЛбәПМъЈЁўуЈ©ЛбјШҫ§Ме![]() ІўІв¶ЁЖдЧйіЙЎЈКөСйТ»ЈәЦЖұёБтЛбСЗМъп§
ІўІв¶ЁЖдЧйіЙЎЈКөСйТ»ЈәЦЖұёБтЛбСЗМъп§![]() ЎЈРЎЧйН¬С§ЙијЖИзНјЛщКҫЧ°ЦГЈЁјРіЦТЗЖчВФИҘЈ©ЎЈ
ЎЈРЎЧйН¬С§ЙијЖИзНјЛщКҫЧ°ЦГЈЁјРіЦТЗЖчВФИҘЈ©ЎЈ
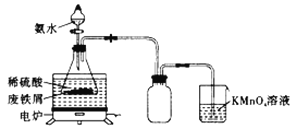
іЖИЎТ»¶ЁБҝөД·ПМъРјУЪЧ¶РОЖҝЦРЈ¬јУИлККБҝөДПЎБтЛбЈ¬ФЪНЁ·зічЦРЦГУЪ50Ў«60ЎжИИЛ®ФЎЦРјУИИЈ¬ід·Ц·ҙУҰЎЈҙэЧ¶РОЖҝЦРИЬТәАдИҙәујУИл°ұЛ®Ј¬ҪБ°иК№Жд·ҙУҰНкИ«Ј¬ЦЖөГЗіВМЙ«РьЧЗТәЎЈ
ЈЁ1Ј©·ПМъРјФЪК№УГЗ°РиТӘУГИИөДұҘәНМјЛбДЖИЬТәҪшРРПҙөУЈ¬ДҝөДКЗ______________________________ЎЈ
ЈЁ2Ј©ФЪКөСйЦРСЎФс50Ў«60ЎжИИЛ®ФЎөДФӯТтКЗ___________________________Ј¬![]() ИЬТәөДЧчУГКЗ________________________ЎЈ
ИЬТәөДЧчУГКЗ________________________ЎЈ
ЈЁ3Ј©ИфТӘИ·ұЈ»сөГЗіВМЙ«РьЧЗТәЈ¬КөСй№эіМУҰЧўТвөДКЗ___________ЈЁМоЧЦДёЈ©ЎЈ
aЈ®ұЈіЦМъРј№эБҝ bЈ®ҝШЦЖИЬТәіКЗҝЛбРФ cЈ®іЦРшЙэёЯОВ¶И
КөСй¶юЈәЦЖұёИэІЭЛбәПМъЈЁўуЈ©ЛбјШҫ§МеЎЈ
КөСйРЎЧйУГКөСйТ»Ч¶РОЖҝЦРөДРьЧЗТәЙијЖТФПВКөСйБчіМЦЖұёИэІЭЛбәПМъЈЁўуЈ©ЛбјШҫ§МеЎЈ
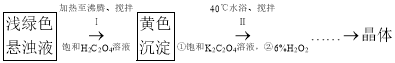
ЈЁ4Ј©РҙіцІҪЦиўсЙъіЙ»ЖЙ«іБөн![]() өД»ҜС§·ҪіМКҪЈә____________________ЎЈ
өД»ҜС§·ҪіМКҪЈә____________________ЎЈ
ЈЁ5Ј©РЎЧйН¬С§ЧјИ·іЖИЎБЛmg·ПМъРјЈ¬ҫӯ№эТФЙПІҪЦиЈЁјЩЙи№эіМЦРМъГ»УРЛрК§Ј©өГөҪИэІЭЛбәПМъЈЁўуЈ©ЛбјШҫ§МеІўЕдЦЖіЙБЛ250mLИЬТәЈ¬ИЎ25mLёГИЬТәУЪЧ¶РОЖҝЦРЈ¬јУИл![]() БтЛбИЬТә15mLЈ¬өОИл¶юұҪ°·»ЗЛбДЖЧчЦёКҫјБЈ¬УГ
БтЛбИЬТә15mLЈ¬өОИл¶юұҪ°·»ЗЛбДЖЧчЦёКҫјБЈ¬УГ![]() өД
өД![]() ұкЧјТәөО¶ЁЦБЧПәмЙ«Ј¬ҪшРРБЛИэҙОЖҪРРКөСйЈ¬ЖҪҫщПыәДұкЧјТә
ұкЧјТәөО¶ЁЦБЧПәмЙ«Ј¬ҪшРРБЛИэҙОЖҪРРКөСйЈ¬ЖҪҫщПыәДұкЧјТә![]() Ј¬ТСЦӘ
Ј¬ТСЦӘ![]() ФЪЛбРФҪйЦКЦРұ»»№ФӯОӘ
ФЪЛбРФҪйЦКЦРұ»»№ФӯОӘ![]() Ј¬Фт·ПМъРјЦРМъФӘЛШөДЦКБҝ·ЦКэОӘ________ЈЁУГПа№ШЧЦДёұнКҫЈ©ЎЈ
Ј¬Фт·ПМъРјЦРМъФӘЛШөДЦКБҝ·ЦКэОӘ________ЈЁУГПа№ШЧЦДёұнКҫЈ©ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёщҫЭПВБРҪб№№КҫТвНјЈ¬ЕР¶ППВБРЛө·ЁЦРХэИ·өДКЗ
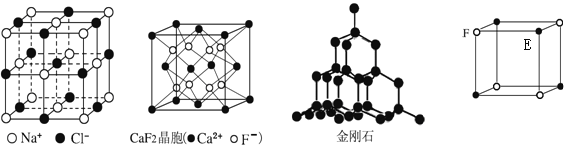
A. ФЪNaClҫ§МеЦРЈ¬ҫаNa+ЧоҪьөД¶аёцCl-№№іЙХэЛДГжМе
B. ФЪCaF2ҫ§МеЦРЈ¬Ca2+өДЕдО»КэОӘ4
C. ФЪҪрёХКҜҫ§МеЦРЈ¬МјФӯЧУУлМјМјјьКэЦ®ұИОӘ1Јә2
D. ёГЖшМ¬НЕҙШ·ЦЧУөД·ЦЧУКҪОӘEF»тFE
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶ЁМхјюПВҙжФЪ·ҙУҰЈәH2(g)+I2(g) ![]() 2HI(g) ЎчH<0.ПЦУРИэёцПаН¬өД1LәгИЭҫшИИ(УлНвҪзГ»УРИИБҝҪ»»»)М¬ұХИЭЖчўсЎўўтЎўўуЈ¬ФЪўсЦРідИлlmolH2әН1molўс2(g)Ј¬ФЪўтЦРідИл2molHl(g).ФЪўсЦРідИл2molH2әН2molI2 (g)Ј¬700ЎжМхјюПВҝӘКј·ҙУҰЎЈҙпөҪЖҪәвКұЈ¬ПВБРЛө·ЁХэИ·өДКЗ()
2HI(g) ЎчH<0.ПЦУРИэёцПаН¬өД1LәгИЭҫшИИ(УлНвҪзГ»УРИИБҝҪ»»»)М¬ұХИЭЖчўсЎўўтЎўўуЈ¬ФЪўсЦРідИлlmolH2әН1molўс2(g)Ј¬ФЪўтЦРідИл2molHl(g).ФЪўсЦРідИл2molH2әН2molI2 (g)Ј¬700ЎжМхјюПВҝӘКј·ҙУҰЎЈҙпөҪЖҪәвКұЈ¬ПВБРЛө·ЁХэИ·өДКЗ()
A. ИЭЖчўсЎўўтЦР·ҙУҰЛЩВКПаН¬
B. ИЭЖчўсЎўўуЦР·ҙУҰөДЖҪәвіЈКэПаН¬
C. ИЭЖчўсЦРөДЖшМеСХЙ«ұИИЭЖчўтЦРөДЖшМеСХЙ«Зі
D. ИЭЖчўсЦРH2өДЧӘ»ҜВКУлИЭЖчўтЦРHIөДЧӘ»ҜЦ®әНРЎУЪ1
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИЛМеөДҪЎҝөУРАөУЪМеДЪёчЦЦФӘЛШөДҫщәвЙгИлЎЈ
ЈЁ1Ј©ХэіЈИЛТ»МмөДКіСОЙгИлБҝІ»і¬№э 6gЎЈ
ўЩіэИҘ NaClИЬТәЦРөДSO42-Ј¬ТАҙОјУИлөДИЬТәОӘЈЁМоИЬЦКөД»ҜС§КҪЈ©Јә№эБҝ______ИЬТәЎў№эБҝ______ИЬТәЎўККБҝПЎСОЛбЎЈ
ўЪКіУГөвСОКЗКіСОЦРјУИл KIO3ЎЈПВұнКЗДіөШКРіЎЙППъКЫөДТ»ЦЦЎ°јУөвСОЎұ°ьЧ°ЙПөДІҝ·ЦОДЧЦЛөГчЎЈ»ШҙрПВБРОКМвЈә
ЕдБПұн | ҫ«ЦЖәЈСОЎўөвЛбјШЈЁKIO3Ј© |
ә¬өвБҝ | 20~40 mg/kg |
ҙўІШ·Ҫ·Ё | ГЬ·вұЬ№вЎў·Аіұ |
КіУГ·Ҫ·Ё | ЕлөчКұҙэКіЖ·КмәујУИлөвСО |
КіУГөвСОЦРЎ°өвЎұКЗЦё______ЈЁМоЎ°өвАлЧУЎұ»тЎ°өвФӘЛШЎұЈ©ЎЈНЖІвіцөвЛбјШЈЁKIO3Ј©»ҜС§РФЦКЈәөвЛбјШЈЁKIO3Ј©ФЪёЯОВКұ______ЈЁМоЎ°ТЧ·ЦҪвЎұ»тЎ°І»ТЧ·ЦҪвЎұЈ©ЎЈТ»ЦЦІв¶Ёә¬өвБҝөД»ҜС§ФӯАнКЗЈә
ЈЁҰ©Ј©KIO3 + KI + H2SO4===K2SO4 + I2 + H2OЈЁОҙЕдЖҪЈ©Ј¬
ЈЁўтЈ©I2 + 2Na2S2O3 = 2NaI + Na2S4O8ЎЈҪ«·ҙУҰ Ұ© ёДРҙОӘАлЧУ·ҪіМКҪ_____
ЈЁ2Ј©іЙИЛГҝМмҙУКіОпЦРЙгИЎ 0.8 g Ca ФӘЛШЎў0.3 g Mg ФӘЛШЎЈ
ўЩCa ФӘЛШУл Mg ФӘЛШОпЦКөДБҝЦ®ұИОӘ______ЎЈ
ўЪД«Уг№З·Ы(ЦчТӘіЙ·ЦКЗ CaCO3Ј©Ј¬ҝЙУГЧчЦОБЖОёЛб№э¶аЈ¬ЖдФӯТтКЗ_________(УГАлЧУ·ҪіМКҪ»Шҙр)ЎЈ
ўЫҙУәЈЛ®ЦРҝЙМбИЎГҫЈәіэИҘ»мФЪ Mg(OH)2 ЦРөД Ca(OH)2 өДЧојС·Ҫ·ЁКЗЈәјУИл№эБҝөД______ЈЁМоЎ°AЎұ»тЎ°BЎұЈ©ЈЁA. MgSO4 ИЬТәЎЎB. MgCl2 ИЬТәЈ©Ј¬№эВЛЈ¬ПҙөУЈ¬өНОВәжёЙЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘЈәX(g)+2Y(g)![]() 3Z(g) ЎчH=-akJЎӨmol-1(a>0)Ј¬ПВБРЛө·ЁІ»ХэИ·өДКЗ
3Z(g) ЎчH=-akJЎӨmol-1(a>0)Ј¬ПВБРЛө·ЁІ»ХэИ·өДКЗ
A. 0.1molXәН0.2molYід·Ц·ҙУҰЙъіЙZөДОпЦКөДБҝТ»¶ЁРЎУЪ0.3mol
B. ҙпөҪ»ҜС§ЖҪәвЧҙМ¬КұЈ¬XЎўYЎўZөДЕЁ¶ИІ»ФЩ·ўЙъұд»Ҝ
C. ҙпөҪ»ҜС§ЖҪәвЧҙМ¬КұЈ¬·ҙУҰ·ЕіцөДЧЬИИБҝҝЙҙпa Kj
D. ЙэёЯ·ҙУҰОВ¶ИЈ¬Дж·ҙУҰЛЩВКФцҙуЈ¬Хэ·ҙУҰЛЩВКјхРЎ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝСхөӘФУКЗРВТ©СРЦЖ№эіМЦР·ўПЦөДТ»АаЦШТӘ»оРФОпЦКЈ¬ДЬУГУЪёДЙЖҙуДФИұСӘЎЈПВГжКЗДіСРҫҝРЎЧйМбіцөДТ»ЦЦСхөӘФУАа»ҜәПОпEөДәПіЙВ·ПЯЈә
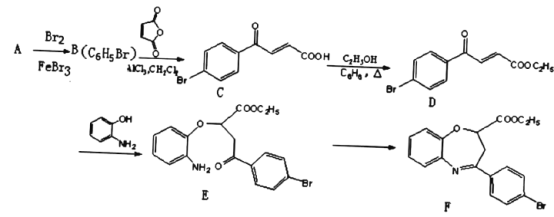
ЈЁ1Ј©AөДҪб№№јтКҪОӘ_____ЎЈCЦР№ЩДЬНЕөДГыіЖОӘ____ЎЈ
ЈЁ2Ј©EЎъFҫӯАъБҪІҪ·ҙУҰЈ¬Жд·ҙУҰАаРНТАҙООӘ______Ўў______ЎЈ
ЈЁ3Ј©Н¬КұВъЧгПВБРМхјюөДDөДТ»ЦЦН¬·ЦТм№№МеөДҪб№№јтКҪОӘ______ЎЈ
I.·ЦЧУЦРә¬УР1ёцұҪ»·Ј»
II.ДЬ·ўЙъТшҫө·ҙУҰЈ»
III.·ЦЧУЦРУР5ЦЦІ»Н¬»ҜС§»·ҫіөДЗвЎЈ
ЈЁ4Ј©1mol DУлЧгБҝNaOHИЬТә·ҙУҰКұЧо¶аПыәД_____molNaOHЎЈ
ЈЁ5Ј©УЙEәПіЙFКұ»№ҝЙДЬЙъіЙёұІъОп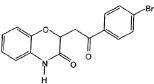 әНТ»ЦЦіЈјыөДУР»ъОпGЈ¬GөДҪб№№јтКҪОӘ_______ЎЈ
әНТ»ЦЦіЈјыөДУР»ъОпGЈ¬GөДҪб№№јтКҪОӘ_______ЎЈ
ЈЁ6Ј©ТСЦӘЈә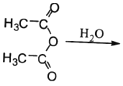 CH3COOHЎЈФӯБП
CH3COOHЎЈФӯБП![]() ЛЧГыЎ°ВнАіфыЎұЈ¬ЛьКЗВнАіЛб
ЛЧГыЎ°ВнАіфыЎұЈ¬ЛьКЗВнАіЛб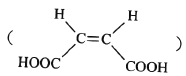 өДЛбфыЎЈЗлРҙіцТФ
өДЛбфыЎЈЗлРҙіцТФ![]() ОӘФӯБПЦЖұё»ҜәПОп
ОӘФӯБПЦЖұё»ҜәПОп өДәПіЙВ·ПЯБчіМНј(ОЮ»ъКФјБИОУГ)ЎЈ______
өДәПіЙВ·ПЯБчіМНј(ОЮ»ъКФјБИОУГ)ЎЈ______
әПіЙВ·ПЯБчіМНјКҫАэИзПВЈәCH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com