
| V |
| Vm |
| 1000��w |
| M |
| 10mL |
| 100mL |
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| V |
| 11.2 |
| V |
| 11.2 |
| VNA |
| 11.2 |
| VNA |
| 11.2 |
| V |
| 22.4 |
| V |
| 22.4 |
| MV |
| 22.4 |
| MV |
| 22.4 |
| ||
1000g+
|
| MV |
| 22400+MV |
| 1000��w |
| M |
1000��d��
| ||
| M |
| 1000Vd |
| 22400+MV |
| 1000Vd |
| 22400+MV |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢ� | B���٢ڢ� |
| C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�8 g���飨CH4���к��е�̼ԭ����Ϊ2NA |
| B����״���£�0.3 mol CO2�к���ԭ����Ϊ0.3NA |
| C��1 mol Na������ˮ��Ӧ��ת�Ƶĵ�����ΪNA |
| D��1 mol?L-1MgCl2��Һ��Clһ������Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ij�����̬�����磬ˮ��Һ�ܵ���˵���þ��������Ӿ��� |
| B��ԭ�Ӿ����ԭ�Ӽ�ֻ���ڹ��ۼ��������Ӿ�����ֻ���ڷ��»��� |
| C�����־���ͷǾ������ѧ�ķ����ǶԹ������X-��������ʵ�� |
| D���κξ����У�������������Ҳһ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ϊ���ԣ�HCl��H2CO3�����Էǽ����ԣ�Cl��C |
| B���ڢ�AԪ�ش��ϵ��£����⻯����ȶ�������ǿ |
| C��ͬ���ڵڢ�A�����IIIA���Ԫ��ԭ������֮�һ��Ϊ1 |
| D��ͬ��������Ԫ�ص�ԭ���γɵļ����ӵ��Ӳ�ṹ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ʵ�����ָ���ʵ����� |
| B�����ʵ�����Ħ������������ |
| C��Ħ���DZ�ʾ���ʵ����ĵ�λ |
| D��CO2��Ħ��������44g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
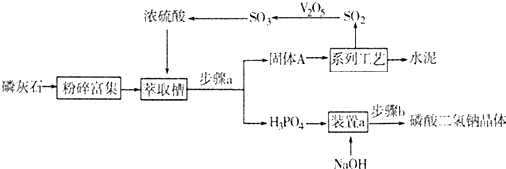
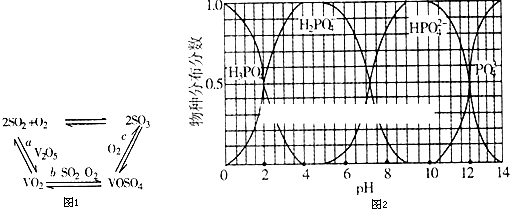
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com