
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是________(填选项字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的________(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置进行电解,一段时间后发现溶液逐渐变浑浊,Al电极附近有气泡生成,写出此过程中阳极的电极反应式______________________ 。
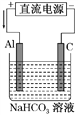
【答案】 C 0.4NA或2.408×1023 负 Al+3HCO3--3e-===Al(OH)3↓+3CO2↑
【解析】试题分析:充电时Fe(OH)2、Ni(OH)2生成NiO2、Fe、H2O,铁元素化合价降低、镍元素化合价升高;放电时Fe失电子生成Fe(OH)2;(2)金属的电化学保护方法有牺牲阳极的阴极保护法和外接电流阴极保护法;(3)Al电极与电源正极相连,Al做阳极失电子发生氧化反应。
解析:充电时Fe(OH)2、Ni(OH)2生成NiO2、Fe、H2O,铁元素化合价降低、镍元素化合价升高,所以发生还原反应的物质是Fe(OH)2,故选C;18 gFe(OH)2的物质的量是0.2mol,放电时Fe失电子生成Fe(OH)2,当生成Fe(OH)2的质量为18 g时,外电路中转移的电子数是0.4NA;(2)金属与蓄电池的负极相连,做电解池阴极,阴极发生还原反应,金属被保护,属于外接电流阴极保护法;(3)Al电极与电源正极相连,Al做阳极失电子发生氧化反应,阳极的电极反应式是Al+3HCO3--3e-===Al(OH)3↓+3CO2↑。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
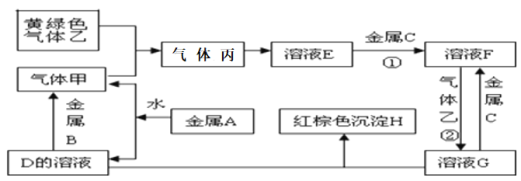
(1)写出下列物质的化学式:乙_________、H__________;
(2)写出反应②的离子方程式______________________;
(3)写出金属A与水反应的离子方程式___________________________;
(4)写出金属B与D的溶液反应的离子方程式____________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式___________;现象为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是 ( )
A. 汉弗莱·戴维 B. 舍勒 C. 阿伏加德罗 D. 侯德榜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是 ( )

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c、d、e四种元素中都存在能促进水的电离的含氧酸盐
D. e和其它四种元素均能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学进行氢氧化铁胶体的制备:
(1)甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确__________。
(2)乙直接加热饱和氯化铁溶液,请评价是否正确__________。
(3)丙向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(4)写出制备氢氧化铁胶体的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5min后,电极5的质量增加2.16g。假设电解过程中溶液的体积不变。

请回答下列问题:
(1)电源中a是_______极。A池中阳极的电极反应式为___________,C池中阴极的电极反应式为___________________________。
(2)通电5min后,如果B槽中共收集到224mL气体(标准状况),且溶液体积为200mL,则通电前溶液中Cu2+的物质的量浓度为___________________。
(3)如果A池溶液是200mL食盐水(假设电解液足量),则通电5min后,溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
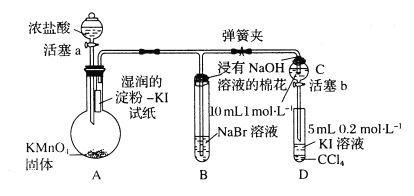
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com