
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |
科目:高中化学 来源: 题型:单选题
A、B分别为同一主族第三周期、第四周期的不同元素的原子,它们原子核内质子数均等于中子数。若A为ⅡA 族,其质量数为x,则B的质子数为Z;若A为ⅣA族,其质子数为y,则B的质量数为N。Z和N为下列哪一组值
A.Z: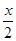 +18,N:2y+18 B.Z:
+18,N:2y+18 B.Z: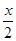 +8, N:2y+18
+8, N:2y+18
C.Z: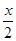 +8, N:2y+36 D.Z:
+8, N:2y+36 D.Z: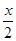 +18, N:2y+36
+18, N:2y+36
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.元素X的简单气态氢化物的热稳定性比W弱 |
| B.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
| C.化合物YX、ZX2、WX3中化学键类型相同 |
| D.原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关原子结构和元素周期律表述正确的是
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
a、b、c、d、e是同周期的五种元素,a和b最高价氧化物对应的水化物呈碱性,且碱性b>a,c 和d的气态氢化物的稳定性c>d;五种元素的原子得失电子后形成的简单离子中 e半径最小,下列叙述中正确的是( )
| A.原子序数关系是b <a< d< c< e | B.离子半径关系是d >c> e> b> a |
| C.原子半径关系是b> a> e> d >c | D.最外层电子数关系为c >d > a >b>e |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质的性质及粒子的性质变化正确的是
| A.稳定性H2S>HCl>HBr>HI | B.酸性HF>HCl>HBr>HI |
| C.离子半径K+>Cl->S2->S | D.酸性HClO4>H2SO4>H2CO3>HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
A.水加热到很高的温度都难以分解是因为水分子间存在氢键
B.碳酸钠固体中不存在阴阳离子
C.氢化锂三兄弟——LiH、LiD、LiT三种物质的质子数之比为4︰5︰6
D.乙醛分子的结构式为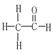 ,其一个分子中存在7对共用电子对
,其一个分子中存在7对共用电子对
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A、B两元素为同周期ⅡA族和ⅢA族元素,若A元素的原子序数为m , 则B元素的原子序数可能为
①m+1 ②m+81 ③m+11 ④m+18 ⑤m+25 ⑥m+32
A.①③⑥ B.①③⑤ C.②④⑤ D.①②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com