
����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5��g��4NO2��g��+O2��g����H��0��T1�¶�ʱ�����ܱ�������ͨ��N2O5���壬����ʵ�����ݼ��±���
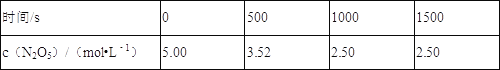
����˵����ȷ���ǣ� ��
A.500_s��NO2����������Ϊ2.96��10��3_molL��1s��1
B.T1�¶��¸÷�Ӧƽ��ʱN2O5��ת����Ϊ29.6%
C.�ﵽƽ�������������䣬�����������ѹ����ԭ��1/2����c��N2O5����5.00molL��
D.T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1��T2����K1��K2
���𰸡�D
��������
A.500s��N2O5����N2O5��ʾ��ƽ������Ϊ��v��N2O5��=![]() =2.96��10-3molL-1s-1����v��NO2��=2v��N2O5��=5.92��10-3molL-1s-1����A����
=2.96��10-3molL-1s-1����v��NO2��=2v��N2O5��=5.92��10-3molL-1s-1����A����
B.���ݱ������ݿ�֪��1000sʱ�ﵽƽ��״̬����ʱN2O5��ƽ��Ũ��Ϊ2.5mol/L����T1�¶��¸÷�Ӧƽ��ʱN2O5��ת����Ϊ![]() ��100%=50%����B����
��100%=50%����B����
C.�ﵽƽ��������������䣬�����������ѹ����ԭ����1/2����ƽ�ⲻ�ƶ�����c��N2O5��=5.00mol/L����С���������ѹǿ����ƽ�����������ƶ�����N2O5��Ũ������c��N2O5��>5.00mol/L����C����
D.��Ӧ2N2O5��g��4NO2��g��+O2��g���ġ�H>0��Ϊ���ȷ�Ӧ�������¶Ⱥ����淴Ӧ���ʶ�������ƽ�����������ƶ�����D��ȷ��
�𰸣�D��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ�Ⱦ�Ϊ0.1 mol/L�������ΪV0��HX��HY���ֱ��ˮϡ�������V��pH��lg V/V0�ı仯��ϵ����ͼ��ʾ������������ȷ����
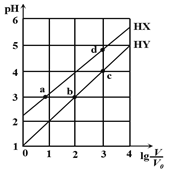
A. a��b�������Һ�У�c��X-����c��Y-��
B. ��ͬ�¶��£����볣��K(HX)��d��a
C. ��Һ��ˮ�ĵĵ���̶ȣ�d��c��b��a
D. lgV/V0=2ʱ����ͬʱ������Һ�壨�����ǻӷ�������c(X-) /c(Y-) ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2O2�ڴ��������·ֽ����ʼӿ죬�������淴Ӧ���̵ı仯����ͼ��ʾ������˵����ȷ����(����)

A. �����������С�˷�Ӧ����ЧӦ
B. ��������������H2O2��ƽ��ת����
C. H2O2�ֽ���Ȼ�ѧ����ʽ��H2O2===H2O��1/2 O2����H>0
D. ��Ӧ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�������ijЩ���������ﷴӦ��ø��۵�������ʵķ�������ҵ�Ͽ�����������̼���̼���Ͻ����ۺͳ����������ȷ�Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+2Al![]() 2Fe+Al2O3
2Fe+Al2O3
��1��������Ӧ�У���Ϊ��ԭ����������__����ѧʽ�������ϼ۽��͵�Ԫ����__�����ƣ���
��2������Ӧ��������0.2mol Al������Fe�����ʵ���Ϊ__mol��ת�Ƶ��ӵ����ʵ���Ϊ__mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ��й���������ƣ�Na2S2O3����������ϣ�
�����������һ�ְ�ɫ�ľ��壬��������ϴ�����Ƭ�Ķ�Ӱ������֯��Ư������ȼ������������еĻ�ԭ�������ڼ��Ի��������ȶ����ڣ������������·�����Ӧ����SO2��S���Ʊ�Na2S2O3�ķ����ܶ࣬���õķ����У���.�������ܽ��������������������������ƣ��ټ�����Ƿ��ڷ�Ӧ�������ˡ�Ũ�����ᾧ���Ƶ���ˮ��������ƣ�Na2S2O3��5H2O������.�������̼���ơ����ƺͷ����еĶ�������Ӧ���������������ᾧ���Ƶ���������ơ���.�������������ƺ��ؽᾧ�����ɺ����ơ��������ƺ��ռ��Һ�徭��������������
�ش��������⣺
��1��Na2S2O3��HCl��Ӧ�����ӷ���ʽ___��
��2�����������������ķ�Ӧ___��д����ʽ����
��3��������������������������___����ѧʽ��������ԭ������__����ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ʣ���A��B��C��D����ɫ��Ӧ�ʻ�ɫ�����ǵĹ�ϵ����ͼ��ʾ����֪EΪ���嵥�ʣ���ʹ�����ǵ�ľ����ȼ��

��1��д���������ʵĻ�ѧʽ��A ��B C ��
D ��E ��
��2��д��A���ȷֽ�Ļ�ѧ����ʽ�� ��
��3��д��Y��C��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ϩ������ϩ������ϩ����ʹ���Ը��������Һ��ɫ
B.����ʽΪC4H7ClO2������NaHCO3����CO2���л�����ܽṹ��3��
C.![]() ������������11��̼ԭ�Ӵ���ͬһƽ����
������������11��̼ԭ�Ӵ���ͬһƽ����
D.1mol�л��� һ���������ܺ�7molNaOH��Ӧ
һ���������ܺ�7molNaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶�ʱCH3COOH�ĵ���ƽ�ⳣ��ΪK�����¶�����20 mL 0.1 mol��L-1 CH3COOH��Һ����μ���0.1 mol��L-1 NaOH��Һ,pH�仯������ͼ��ʾ�������¶���,����������ȷ����
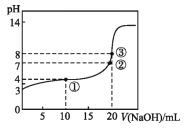
A������ͼ�����ݿɼ����KֵԼΪ1��10-5
B���٢ڢ۵�ˮ�ĵ���̶��ɴ�С��˳��Ϊ:��>��>��
C�������ʾ��Һ��:c��CH3COO-��+c��OH-��=c��CH3COOH��+c��H+��
D�����ʱc��CH3COOH��+c��CH3COO-��=0.1 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ijŨ��H3PO4��Һ����μ���NaOH��Һ���μӹ����и��ֺ����������ʵ�������![]() ����ҺpH�ı仯��������ͼ��ʾ������˵����ȷ����( )
����ҺpH�ı仯��������ͼ��ʾ������˵����ȷ����( )
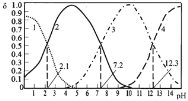
A.����1������2�ֱ��ʾ![]() (H3PO4)��
(H3PO4)��![]() (HPO42-)�ı仯
(HPO42-)�ı仯
B.25��ʱ��H3PO4�ĵ��볣��K1=10-2.1
C.pH=7.2ʱ����Һ��c(H2PO4-)+c(HPO42-)+c(OH-)=c(Na+)+c(H+)
D.pH=12.3ʱ����Һ����ˮ�������c(H+)=10-12.3 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com