
分析 (1)某二元化合物X其相对分子质量小于100,12.25g KClO3与9g草酸恰好完全反应生成X、CO2和一种酸式盐,n(KClO3)=$\frac{12.25g}{122.5g/mol}$=0.1mol,n(H2C2O4)=$\frac{9g}{90g/mol}$=0.1mol,由于生成物中有一种酸式盐,所以依据氧化还原反应电子守恒分析得到:H2C2O4~2CO2~2e-,KClO3被还原生成的化合物中氯元素化合价为x,根据电子守恒计算出x并判断X的化学式;
(2)该反应产中有二氧化碳生成,可稀释Cl02,大大降低爆炸的可能性;
(3)二氧化氯具有强的氧化性,能够氧化二价锰离子生成二氧化锰,本身被还原为氯离子,据此根据化合价升降相等配平;
(4)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;
(5)生成等物质的量的两种钠盐,其中有一种盐为NaClO3,根据电子守恒判断另一种反应产物,然后写出反应的化学方程式;
(6)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)某二元化合物X其相对分子质量小于100,12.25g KClO3与9g草酸恰好完全反应生成X、CO2和一种酸式盐,n(KClO3)=$\frac{12.25g}{122.5g/mol}$=0.1mol,n(H2C2O4)=$\frac{9g}{90g/mol}$=0.1mol,由于生成物中有一种酸式盐,所以依据氧化还原反应电子守恒分析得到:H2C2O4~2CO2~2e-,KClO3被还原后的生成的化合物中Cl元素化合价为x,则得到:(5-x)×0.1mol=$\frac{1}{2}$×0.1mol×2×(4-3),解得:x=4,则X的化学式为:ClO2,
故答案为:ClO2;
(2)用H2C204溶液、稀硫酸和KC103制备ClO2反应产物为二氧化氯、二氧化碳可稀释Cl02,大大降低爆炸的可能性,
故答案为:制得Cl02的同时有CO2产生,可稀释Cl02,大大降低爆炸的可能性;
(3)二氧化氯具有强的氧化性,能够氧化二价锰离子生成二氧化锰,本身被还原为氯离子,离子方程式:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+,
故答案为:2ClO2+5 Mn2++6H2O=5 MnO2↓+2 Cl-+12H+;
(4)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为:C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
故答案为:C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4;
(5)用氢氧化钠溶液吸收ClO2尾气,生成等物质的量的两种钠盐,其中有一种盐为NaClO3,根据电子守恒,另一种盐为NaClO2,反应的化学方程式为:2NaOH+2ClO2=NaClO3+NaClO2+H2O,
故答案为:2NaOH+2ClO2=NaClO3+NaClO2+H2O;
(6)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的:$\frac{5mol}{2mol}$=2.5倍,
故答案为:2.5.
点评 本题考查无机物的推断,题目难度中等,涉及氧化还原反应的计算、未知物推断、化学方程式、离子方程式的书写等知识,根据题干信息正确推断X的化学式为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点:CF4>CCl4>CBr4>CI4 | |
| B. | 硬度:金刚石>晶体硅>碳化硅 | |
| C. | 沸点:HF<HCl<HBr<HI | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 | |
| B. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3OOCCH3乙酸甲酯 | ||
| C. |  硬脂酸甘油脂 硬脂酸甘油脂 | D. | 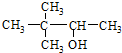 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
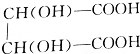 +2NaOH=
+2NaOH=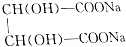 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有⑤⑦ | C. | 只有①③⑦ | D. | 只有①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com