
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3OOCCH3乙酸甲酯 | ||
| C. |  硬脂酸甘油脂 硬脂酸甘油脂 | D. | 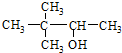 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
分析 A、卤代烃的命名中,必需标明卤素原子所在的位置;
B、酯名称为某酸某酯;
C、硬脂酸甘油酯为饱和三元酯;
D、醇类的命名选取距离羟基最近的一端命名为1号碳.
解答 解:A、CH2BrCH2Br为卤代烃,Br原子分别在1、2号碳上,正确命名为1,2-二溴乙烷,故A错误;
B、CH3OOCCH3 名称为乙酸甲酯,故B正确;
C、硬脂酸甘油酯,属于酯类,命名中出现错字“脂”,故C错误;
D、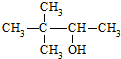 为丁醇,羟基在2号碳上,正确命名为3,3-二甲基-2-丁醇,故D错误,
为丁醇,羟基在2号碳上,正确命名为3,3-二甲基-2-丁醇,故D错误,
故选B.
点评 本题主要考查的是卤代烃的命名、醇类的命名以及酯类的命名,题目难度不大,掌握各种的命名原则是解决本题的关键,注意“酯”和“脂”的区别.


科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| 物质 | 加碘食盐 | 石英砂 | “84”消毒液 | 水玻璃 |
| 主要成分 | KIO3 | SiO2 | Ca(ClO)2 | NaSiO3 |
| 用途 | 预防碘缺乏病 | 作干燥剂 | 作消毒剂 | 木材防火剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
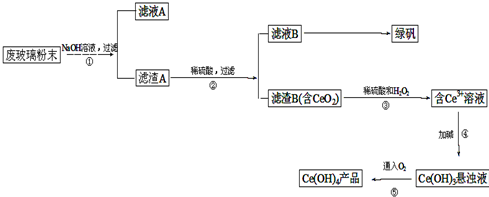
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
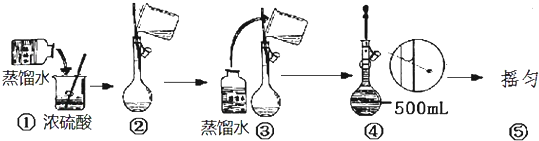

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
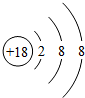 ,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.
,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com