
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成Na2CO3,溶液中CO32-能发生两步水解都生成OH-,但水解程度较小;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后,溶液中溶质为等物质的量浓度的CH3COONa、CH3COOH和NaCl,CH3COOH电离程度大于CH3COO-水解程度导致溶液呈酸性,结合物料守恒判断;
C.一水合氨是弱电解质、HCl是强电解质,室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合氨水有剩余,溶液呈碱性,但溶液中仍然存在电荷守恒;
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成CH3COONa,溶液中存在质子守恒,根据质子守恒判断.
解答 解:A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成Na2CO3,溶液中CO32-能发生两步水解都生成OH-,但水解程度较小,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后,溶液中溶质为等物质的量浓度的CH3COONa、CH3COOH和NaCl,CH3COOH电离程度大于CH3COO-水解程度导致溶液呈酸性,但醋酸电离程度较小,结合物料守恒得c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.一水合氨是弱电解质、HCl是强电解质,室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合氨水有剩余,溶液呈碱性,则c(H+)<c(OH-),但溶液中仍然存在电荷守恒,根据电荷守恒得c(Cl-)<c(NH4+),所以得c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成CH3COONa,溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,知道弱电解质电离特点,灵活运用溶液中存在的电荷守恒、物料守恒和质子守恒,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO2的水溶液能导电,所以CO2是电解质 | |
| B. | 氧化剂在反应中得到的电子越多,氧化能力越强 | |
| C. | 分散质粒子大小为几纳米到几百十纳米的分散系是胶体 | |
| D. | Cl2的氧化性比I2强,而I-的还原性却比Cl-强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含Na2CO3的溶液:K+、Cl-、NO3-、Al3+ | |
| B. | pH=11的溶液:Ba2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ | |
| D. | 滴加甲基橙试液显红色的溶液:Fe3+、NH4+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
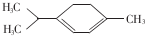 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
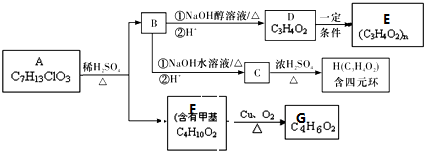
 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com