
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:
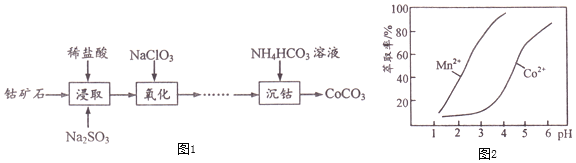
下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]() 已知金属萃取剂对金属离子的萃取率与pH的关系如图2所示。请补充完整由“氧化”后的溶液制备
已知金属萃取剂对金属离子的萃取率与pH的关系如图2所示。请补充完整由“氧化”后的溶液制备![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。
【答案】![]()
![]() 、
、![]() 与
与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() 水浴加热 温度过高
水浴加热 温度过高![]() 易分解,温度过低反应速率缓慢
易分解,温度过低反应速率缓慢 ![]() 溶液,调节溶液的pH至
溶液,调节溶液的pH至![]() ,过滤,向滤液中加入稀盐酸调pH至
,过滤,向滤液中加入稀盐酸调pH至![]() 左右,加入金属萃取剂萃取
左右,加入金属萃取剂萃取![]() 次,静置后分液,得较纯
次,静置后分液,得较纯![]() 溶液
溶液
【解析】
用钴矿石![]() 含
含![]() 、
、![]() 及少量
及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() ,钴矿石加入稀盐酸和亚硫酸钠,铁离子和二氧化锰被亚硫酸钠还原得到亚铁离子和锰离子,加入氯酸钠氧化亚铁离子为铁离子,氧化后的溶液中加入碳酸钠溶液调节溶液的pH至
,钴矿石加入稀盐酸和亚硫酸钠,铁离子和二氧化锰被亚硫酸钠还原得到亚铁离子和锰离子,加入氯酸钠氧化亚铁离子为铁离子,氧化后的溶液中加入碳酸钠溶液调节溶液的pH至![]() ,沉淀铁离子和氯离子,过滤,向滤液中加入稀盐酸调pH至
,沉淀铁离子和氯离子,过滤,向滤液中加入稀盐酸调pH至![]() 左右,滤液中加入萃取剂的作用是除去锰离子,根据图像可知,调节溶液PH在
左右,滤液中加入萃取剂的作用是除去锰离子,根据图像可知,调节溶液PH在![]() 之间,可以除去Co2+中的Mn2+,加入
之间,可以除去Co2+中的Mn2+,加入![]() 溶液沉钴得
溶液沉钴得![]() 。
。
![]() “浸取”步骤
“浸取”步骤![]() 发生反应是在酸溶液中和亚硫酸钠反应生成硫酸钴和水,反应的离子方程式为:
发生反应是在酸溶液中和亚硫酸钠反应生成硫酸钴和水,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 浸取”步骤
浸取”步骤![]() 能还原
能还原![]() ,氧化铁和二氧化锰也具有氧化性,能和
,氧化铁和二氧化锰也具有氧化性,能和![]() 发生氧化还原反应,故钴矿石中还能被
发生氧化还原反应,故钴矿石中还能被![]() 还原的物质有:
还原的物质有:![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() ;
;
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是:酸性条件下ClO3-与
的用量过多会造成的不良后果是:酸性条件下ClO3-与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() ,
,
故答案为:与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() ;
;
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为:水浴加热,温度控制在
条件下进行,适宜的加热方式为:水浴加热,温度控制在![]() 的原因是温度过高碳酸氢铵会分解,温度过低反应速率慢,
的原因是温度过高碳酸氢铵会分解,温度过低反应速率慢,
故答案为:水浴加热;温度过高![]() 易分解,温度过低反应速率缓慢;
易分解,温度过低反应速率缓慢;
![]() 氧化后的溶液中含有Fe3+、Al3+、Mn2+、Co2+、Na+、Cl-、SO42-等离子,可以通过调节溶液的PH除去Fe3+和Al3+,根据金属离子沉淀的PH范围的表格可知需要控制溶液的PH在5.2到7.6之间,使Fe3+、Al3+完全沉淀而Co2+不沉淀。Mn2+不能通过调节溶液的PH的方法除去,根据金属萃取剂对金属离子的萃取率与pH的关系图像可知,Mn2+可以用萃取的方法除去,在PH在3.5左右时,Mn2+的萃取率能达到80%以上而Co2+的萃取率不足20%,可以除去Co2+中的Mn2+。根据给出的试剂,调节溶液的PH至
氧化后的溶液中含有Fe3+、Al3+、Mn2+、Co2+、Na+、Cl-、SO42-等离子,可以通过调节溶液的PH除去Fe3+和Al3+,根据金属离子沉淀的PH范围的表格可知需要控制溶液的PH在5.2到7.6之间,使Fe3+、Al3+完全沉淀而Co2+不沉淀。Mn2+不能通过调节溶液的PH的方法除去,根据金属萃取剂对金属离子的萃取率与pH的关系图像可知,Mn2+可以用萃取的方法除去,在PH在3.5左右时,Mn2+的萃取率能达到80%以上而Co2+的萃取率不足20%,可以除去Co2+中的Mn2+。根据给出的试剂,调节溶液的PH至![]() 的试剂用Na2CO3溶液,调节溶液pH至
的试剂用Na2CO3溶液,调节溶液pH至![]() 左右,用的试剂是稀盐酸,
左右,用的试剂是稀盐酸,
故答案为:![]() 溶液,调节溶液的pH至
溶液,调节溶液的pH至![]() ,过滤,向滤液中加入稀盐酸调pH至
,过滤,向滤液中加入稀盐酸调pH至![]() 左右,加入金属萃取剂萃取
左右,加入金属萃取剂萃取![]() 次,静置后分液,得较纯
次,静置后分液,得较纯![]() 溶液。
溶液。


科目:高中化学 来源: 题型:
【题目】将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
A.若恒容下,充入氮气,则c(SO3)小于0.04mol·L-1
B.该条件下反应的平衡常数为1.6×103
C.v(O2)= 0.02 mol·L-1.min-1
D.使用催化剂若平衡没有移动,则该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25 。下列有关说法正确的是( )

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从“南澳一号”沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。青花瓷胎体的原料--高岭土![]() ,可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石
,可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石![]() ,在
,在![]() 左右一次烧成的釉可形成精美的青花瓷。
左右一次烧成的釉可形成精美的青花瓷。
![]() 高岭土分子中
高岭土分子中![]() ______,青花瓷______
______,青花瓷______![]() 填“属于”或“不属于”硅酸盐产品。
填“属于”或“不属于”硅酸盐产品。
![]() 在“南澳一号”考古直播过程中,需用高纯度
在“南澳一号”考古直播过程中,需用高纯度![]() 制造的光纤。下图是用海边的石英砂
制造的光纤。下图是用海边的石英砂![]() 含氯化钠、氧化铝等杂质
含氯化钠、氧化铝等杂质![]() 制备二氧化硅粗产品的工艺流程。
制备二氧化硅粗产品的工艺流程。
①洗涤石英砂的目的是______。
②在以上流程中,要将洗净的石英砂研磨成粉末,目的是______。
![]() 工业上常用二氧化硅与碳在高温下发生反应制造粗硅,粗硅中含有SiC,生成物中Si和SiC的物质的量之比为1:
工业上常用二氧化硅与碳在高温下发生反应制造粗硅,粗硅中含有SiC,生成物中Si和SiC的物质的量之比为1:![]() 写出其化学方程式______。
写出其化学方程式______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如下图装置。下列叙述不正确的是
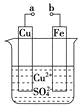
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.a和b用导线连接时,电子由铜电极流向铁电极
D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作与现象、结论都正确且有相关性的是
选项 | 操作 | 现象 | 结论 |
A |
|
| 原溶液中仍有 |
B | 向含有ZnS和 | 生成黑色沉淀 |
|
C | 向 | 溶液变浑浊 | 酸性 |
D | 向乙酸乙酯粗产品中加入少量 | 产生大量气泡 | 乙酸乙酯产品中混有乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答下列问题:

(1)B极是电源的___;一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明___,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___。
(3)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是___。
(4)现用丙装置给铜件镀银,则H应该是__(填“镀层金属”或“镀件”)。当乙中溶液的pH是13时(乙溶液体积为500mL,不考虑反应过程溶液体积变化),丙中镀件上析出银的质量为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
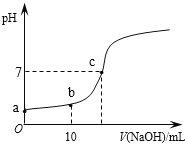
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com