
| 1000ρw% |
| M |
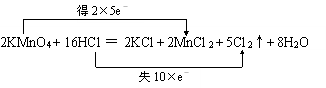 ,答:双线桥法标出反应中电子得失数目为:
,答:双线桥法标出反应中电子得失数目为: .
.| 1000ρw% |
| M |
| 1000×1.19×36.5% |
| 36.5 |
| 15.8g |
| 158g/mol |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、15.5 | B、42 |
| C、31 | D、21 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 s |
| B、2.5 s |
| C、5 s |
| D、10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:
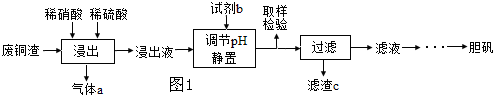
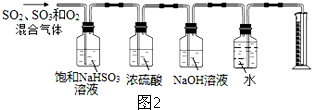
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100ml |
| B、25ml |
| C、50ml |
| D、由于Mg、MgO的质量未知无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com