
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | ⑧ | | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |
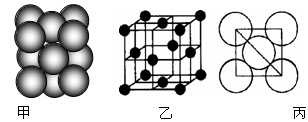
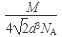 (2分)
(2分)

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
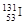 、
、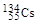 、
、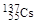 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )A.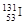 和 和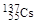 位于同一周期 位于同一周期 |
B.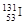 和 和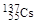 具有相同的中子数 具有相同的中子数 |
C.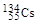 原子半径小于 原子半径小于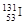 原子半径 原子半径 |
| D.Cs元素最高价氧化物对应的水化物呈强碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①④⑤ | C.②④⑤ | D.②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
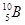 和
和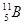 两种同位素构成的。已知5.4克晶体硼(B)全部氢化生成B2H6 (硼烷)气体时,可得标准状况下5.6L硼烷,则晶体硼中
两种同位素构成的。已知5.4克晶体硼(B)全部氢化生成B2H6 (硼烷)气体时,可得标准状况下5.6L硼烷,则晶体硼中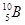 和
和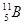 两种核素的原子个数比是
两种核素的原子个数比是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
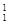 H、
H、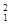 H、
H、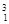 H、
H、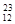 Mg、
Mg、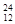 Mg和
Mg和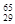 Cu中共有___ ___种元素,__ ____种原子。
Cu中共有___ ___种元素,__ ____种原子。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com