
(8分)【化学-化学与技术】
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
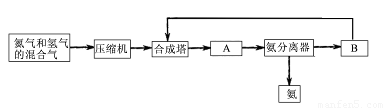
(1)合成氨所需要的原料气中,氮气取自 ,氢气来源于 。
(2)对原料气进行净化处理的目的是 。
(3)设备A的名称是 ,设备B的名称是 。
(4)在10~30Mpa时,工业合成氨选择400~500 ℃的温度进行反应,主要原因是 。
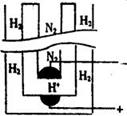
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分另通入一个加热到570 ℃的电解池(如图)中,氢和氮在电极上合成了氨,且转化率达到了78%。
则阳极反应为 ,阴极反应为 。
⑴空气(1分) 水和碳氢化合物(1分) ⑵防止催化剂中毒(1分)
⑶冷凝器(1分) 循环压缩机(1分)
⑷温度500 ℃是因为温度太高,平衡混合物中氨的含量太低;温度太低,则化学反应速率太小。而且500 ℃,催化剂活性最大。(1分)
⑸H2-2e -=2H+(1分) N2+6e-+6H+=2NH3(1分)
【解析】⑴空气的主要成分是氮气,所以合成氨所需要的原料气中,氮气取自空气。而氢气来源于水和碳氢化合物。
⑵原料气中含有杂质,如果不处理会造成催化剂中毒,所以对原料气进行净化处理,是为了防止催化剂中毒。
⑶设备A为冷凝器,设备B为循环压缩机。
⑷选择400~500 ℃的温度,是综合反应速率、反应限度及催化剂活性等考虑。因为温度太高,平衡混合物中氨的含量太低;温度太低,则化学反应速率太小。而且500 ℃,催化剂活性最大。
⑸该装置为电解池,阳极失去电子,所以氢气在阳极通入,阳极反应为H2-2e -=2H+,阴极得到电子,因此氮气在阴极通入,所以阴极反应为N2+6e-+6H+=2NH3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com