
短周期主族元素X、Y、Z、W 的原子序数依次增大, X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是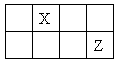
| A.原子半径: r(Y)> r (Z)> r (W) |
| B.Y、Z、W的简单离子的电子层结构相同 |
| C.XWm与YWn中化学键类型相同(m、n为正整数) |
| D.元素Z 的简单气态氢化物的热稳定性比W 的强 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
| D.IA族与VIIA族元素间形成的化合物,有共价化合物也有离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A.XY2 | B.X2Y3 | C.X3Y2 | D.XY2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及主要化合价如下表
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列能说明氯元素比硫元素非金属性强的是
①HCl比H2S稳定;
②HClO4酸性比H2SO4强;
③Cl2能与H2S反应生成S;
④Cl原子最外层有7个电子,S原子最外层有6个电子;
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;
⑥盐酸是强酸,而氢硫酸是弱酸
| A.①②③④⑤⑥ | B.①②③④⑥ | C.①②③⑤ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素性质呈周期性变化的决定因素是
| A.元素原子核外电子层排布呈周期性变化 |
| B.元素相对原子质量依次递增 |
| C.元素原子半径大小呈周期性变化 |
| D.元素的最高正化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于元素周期表和元素周期律的说法错误的是
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐增强 |
| C.因为Na比K容易失去电子,所以Na比K的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.短周期元素形成离子后,最外层均达8电子稳定结构 |
| B.多电子原子中,在离核较近的区域运动的电子能量较低 |
| C.非金属元素组成的化合物中只有共价键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A.B元素处于元素周期表中第三周期ⅥA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com