
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经6min后测得D的浓度为0.75mol/L,c(A):c(B)=3:5,以C表示的平均反应速率v(C)=0.125mol/(L·min),下列说法正确的是
A.以B表示的平均反应速率为v(B)=0.03125mol/(L·min)
B.6min时,转化了的A占起始A的50%
C.该反应方程式中,x=3
D.6min时,A的物质的量为0.75mol
【答案】B
【解析】
设A、B的物质的量分别为nmol,6min后C的浓度为0.125 mol·L-1·min-1×6min=0.75mol/L,则6min后n(C)=0.75mol/L×2L=1.5mol,n(D)=0.75mol/L×2L=1.5mol,列“三段式”:

则(n-2.25):(n-0.75)=3:5,n=4.5,0.75x=1.5,解得x=2,据此分析解答。
A.反应速率之比等于计量系数比,以B表示的平均反应速率为v(B)=![]() v(C)=
v(C)=![]() ×0.125mol/(L·min)=0.0625mol/(L·min),故A错误;
×0.125mol/(L·min)=0.0625mol/(L·min),故A错误;
B.6min时,A的转化率=![]() ×100%=50%,故B正确;
×100%=50%,故B正确;
C.根据分析,该反应方程式中,x=2,故C错误;
D.6min时,A的物质的量为4.5mol-2.25mol=2.25mol,故D错误;
答案选B。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如Fe+Cu2+=Fe2++Cu,可拆写为氧化反应式:Fe-2e-=Fe2+,还原反应式:Cu2++2e-=Cu。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(2)将反应2Fe3++Cu=2Fe2++Cu2+拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(3)已知某反应的两个“半反应式”为:氧化反应式CH4+10OH--8e-=![]() +7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
+7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构______________
(2)请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体:________ 黄绿色固体:________
(3)淡黄色固体物质是由________分子组成,黄绿色固体物质是由_______分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积不变的密闭容器中进行如下可逆反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g),下列能表明该反应已达到化学平衡状态的是
①v正(SiF4)=4v逆(HF)②HF的体积分数不再变化③容器内气体压强不再变化
④混合气体的密度保持不变⑤4molO—H键断裂的同时,有2molH—F键断裂
A.①②③④B.②③④C.②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L己烷中含有碳原子的数目为6NA
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
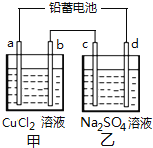
A.d极为阴极
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C.若利用甲池精炼铜,b极应为粗铜
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L标准状况下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置__________;
(2)写出一种由a、c、d所形成的离子化合物__________ (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是_____________________;
(3)c的单质的电子式为__________。
(4)b和d相比,非金属性较强的是__________ (用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为: |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的官能团名称为________。写出A在一定条件下反应生成高分子化合物的方程式:___________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=___________________时,这类有机物开始出现同分异构体。
(3)关于B的说法正确的是:___________________。
a、所有原子在同一个平面上 b、六个碳原子之间是单双建交替的结构
c、一个B分子含有6个σ键 d、含有苯环的化合物成为芳香化合物
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为___________________;其化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N2 0.6mol,H2 0.5mol,在一定温度下进行反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入氖气,则平衡将____(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
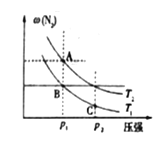
a.A、B、C三点的平衡常数大小关系:KA<KB<KC
b.A点和B点混合气体的密度大小关系:A<B
c.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置如图所示:
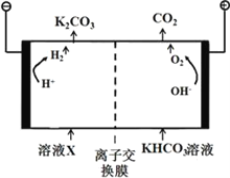
①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理___________________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,
工业上利用该反应合成甲醇。已知:25℃,101KPa下:
2H2(g)+O2(g)=2H2O(g) ΔH1=—484kJ/mol
2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(g) ΔH2=—1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com