
25 ℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b B.a>b
C.c(A-)=c(Na+) D.c(A-)< c(Na+)
c(Na+)
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键 D.共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2和K1的单位均为mol·L-1
B.K2>K1
C.c2(CO)=c2(H2O)
D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上在合成塔中采用下列反应合成甲醇。
CO(g)+2H2(g)  CH3OH(g) ΔH=Q kJ·mol-1
CH3OH(g) ΔH=Q kJ·mol-1
(1)下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断Q________0(填“>”、“<”或“=”),该反应在________(填“较高”或“较低”)温度下有利于自发进行。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2 mol·L-1,此时对应的温度为____________;CO的转化率为____________。
H2充入2 L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2 mol·L-1,此时对应的温度为____________;CO的转化率为____________。
(2)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2)。

(3)要提高CO的转化率且提高反应速率,可以采取的措施是________(填字母序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.通入H2加压 e.通入惰性气体加压 f.分离出甲醇
(4)已知一定 条件下,CO与H2在催化剂的作用下生成5 mol CH3OH时,能
条件下,CO与H2在催化剂的作用下生成5 mol CH3OH时,能 量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
| 平衡时数据 | 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| CH3OH的浓度(mol·L-1) | c1 | c2 | c3 | |
| 反应吸收或放出的能量(kJ) | a | b | c | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是________(填字母序号)。
A.2c1>c3 B.a+b<90.8
C.2p2<p3 D.α1+α3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,0.1 mol·L-1的HA溶液中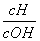 =1010,0.01 mol·L-1的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol·L-1的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是________。
(2)HA的电离方程式为_______________________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.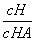
B.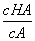
C.c(H+)与c(OH-)的乘积
D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则
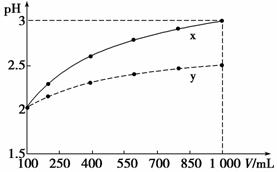
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质与常用危险化学品的类别不对应的是( )
A.H2SO4、NaOH——腐蚀品
B.CH4、C2H4——易燃液体
C.K、Na——遇湿易燃物品
D.KMnO4、K2Cr2O7——氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等。某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
海水 滤液
滤液 滤液
滤液 NaCl溶液
NaCl溶液 NaCl
NaCl
(1 )步骤Ⅰ中试剂A为________,加入过量A的目的是________________________。
)步骤Ⅰ中试剂A为________,加入过量A的目的是________________________。
(2)步骤Ⅱ中试剂B为________,加入过量B的目的是________________________。
(3)步骤Ⅲ中试剂C为________,加入适量C至________,其目的是________________________。
(4)步骤Ⅳ的实验操作为________,试根据图示回答:
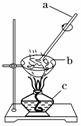
①按顺序写出图中编号仪器的名称:_______________________________;
②仪器a的作用是____________________,其目的是____________________;
③当仪器b中出现________时即可停止加热。
(5)该化学兴趣小组用分离得到的氯化钠配制100 mL 1 mol/L的NaCl溶液,配制过程中需用托盘天平称取精盐的质量为________g,用于定容的玻璃仪器的规格和名称是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb,下列有关a的说法中正确的是
A.a可能等于1 B.a一定大于2
C.a一定小于2 D.a一定等于2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com