
工业上在合成塔中采用下列反应合成甲醇。
CO(g)+2H2(g)  CH3OH(g) ΔH=Q kJ·mol-1
CH3OH(g) ΔH=Q kJ·mol-1
(1)下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断Q________0(填“>”、“<”或“=”),该反应在________(填“较高”或“较低”)温度下有利于自发进行。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2 mol·L-1,此时对应的温度为____________;CO的转化率为____________。
H2充入2 L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2 mol·L-1,此时对应的温度为____________;CO的转化率为____________。
(2)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2)。

(3)要提高CO的转化率且提高反应速率,可以采取的措施是________(填字母序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.通入H2加压 e.通入惰性气体加压 f.分离出甲醇
(4)已知一定 条件下,CO与H2在催化剂的作用下生成5 mol CH3OH时,能
条件下,CO与H2在催化剂的作用下生成5 mol CH3OH时,能 量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
| 平衡时数据 | 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| CH3OH的浓度(mol·L-1) | c1 | c2 | c3 | |
| 反应吸收或放出的能量(kJ) | a | b | c | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是________(填字母序号)。
A.2c1>c3 B.a+b<90.8
C.2p2<p3 D.α1+α3<1
科目:高中化学 来源: 题型:
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOx、CO和C等,请回答下列有关问题。
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为__________________________________________,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由________能转化为________能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中______________(填化学式,多填本空不得分)的排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOx与CO反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应Fe(s)+CO2(g) 
 FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=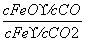
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向体积为2 L的恒容密闭容器中充入1 mol PCl5(g),发生反应:PCl5(g)  PCl3(g)+Cl2(g) ΔH=+Q kJ·mol-1。维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是
PCl3(g)+Cl2(g) ΔH=+Q kJ·mol-1。维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是
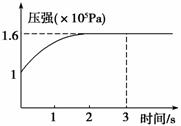
A.3 s内的平均速率为:v(PCl3)=0.1 mol·L-1·min-1
B.达到平衡时放出0.6Q kJ热量
C.其他条件不变,再向容器中充入1 mol PCl5(g),则达新平衡时,c(PCl5)>0.4 mol·L-1
D.其他条件不变,增大PCl5的浓度,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电离平衡常数(K)的说法正确的是
A.电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b B.a>b
C.c(A-)=c(Na+) D.c(A-)< c(Na+)
c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作错误的是( )
A.用药匙取用粉末状或小颗粒状固体
B.用胶头滴管滴加少量液体
C.给盛有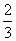 体积液体的试管加热
体积液体的试管加热
D.倾倒液体时试剂瓶标签面向手心
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.200 0 mol·L-1的标准N aOH溶液滴定未知浓度的盐酸,其操作为如下几步:
aOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待 测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是________________(填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟内不变色。
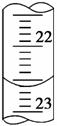
(3)如图是某次滴定时的滴定管中的液面,其读数为________ mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为________ mol·L-1。
| 滴定 次数 | 待测液 体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 2 | 4.0 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com