
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度________________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H5++H2O N2H4+H2O![]() N2H5++OH-
N2H5++OH-
N2H5++H2O![]() N2H62++OH- N2H5++ H2O
N2H62++OH- N2H5++ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)发射火箭时肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知3.2gN2H4(l)在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式
________ 。
因此肼可以作为火箭推进剂。根据该反应,你认为是否可以通过改变反应条件,由N2和水来制取N2H4,若能,指出可能的反应条件;若不能,请指出原因。
。
(1)![]()
(2)2NH3![]() NH4++NH2-
NH4++NH2-
(3)大于;[NO3-]>[NH4+]>[Na+]>[OH-] >[H+]
(4)C
(5)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-642.2 kJ·mol-1,
不能;由于该反应放出大量的热,其逆反应需要吸收大量的热,即逆反应的△H是很大的正值,且由N2和水蒸气生成肼和双氧水是熵减小的,因此反应:N2(g)+4H2O(g)=N2H4(l)+2H2O2(l)的△H-T△S总是大于零,说明该反应不能自发进行,故不能用N2和水来制取N2H4。
(1)N2的电子式为:![]()
(2)由于液态NH3类似H2O,故可由水的电离:2H2O![]() H3O++OH-写出液态NH3电离方程式:2NH3
H3O++OH-写出液态NH3电离方程式:2NH3![]() NH4++NH2-。
NH4++NH2-。
(3)NH4+水解,促进水的电离,NaOH溶液中OH-抑制水的电离,故:0.1mol·L-1 NH4NO3溶液中水的电离程度大于0.1mol·L-lNaOH溶液中水的电离程度。将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合后得等物质的量NH4NO3、NaNO3和NH3·H2O,所得溶液中离子浓度由大到小的顺序为[NO3-]>[NH4+]>[Na+]>[OH-] >[H+]。
(4)由信息知肼水解显弱性,肼在水中电离出OH-离子,且为肼是二元弱碱。
(5)3.2gN2H4(l)为0.1 mol,在上述反应中放出64.22kJ的热量,该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-642.2 kJ·mol-1。
不能通过改变反应条件由N2和水来制取N2H4,原因是:由于该反应放出大量的热,其逆反应需要吸收大量的热,即逆反应的△H是很大的正值,且由N2和水蒸气生成肼和双氧水是熵减小的,因此反应:N2(g)+4H2O(g)=N2H4(l)+2H2O2(l)的△H-T△S总是大于零,说明该反应不能自发进行,故不能用N2和水来制取N2H4。


科目:高中化学 来源:新课标2007年高考化学模拟试题(山东卷) 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出N2的电子式_________________________________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol.L-1NH4NO3溶液中水的电离程度___________(填“大于”“等于”或“小于”)0.1 mol·L-1NaOH溶液中水的电离程度。若将0.1 mOl·L-1NaOH和0.2 m01.L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为______________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+====![]() + H2O
+ H2O
N2H4+ H2O![]()
![]() + OH-
+ OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是__________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO====NaCl+______N2H4+______ ______
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式)___________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省洛阳市高三“一练”考试化学试卷 题型:填空题
(10分)发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)N2H4燃烧时用NO2作氧化剂,它们相互反应生成氮气和水蒸气。
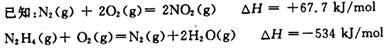
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为 。
(2)利用肼、氧气与KOH溶液组成碱性燃料电池,氮元素被氧化后只生成氮气,请写出该电池工作时负极的电极反应 ;电池工作时, 极pH升高。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式 。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式______________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为______________________________。
(3)25℃时,0.1 mol?L-1 NH4NO3溶液中水的电离程度_______(填“大于”、“等于“或“小于”)0.1 mol?L-l NaOH溶液中水的电离程度。若将0.1mol?L-1NaOH和0.2mol?L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H![]() +H2O N2H4+H2O
+H2O N2H4+H2O![]() N2H
N2H![]() +OH-
+OH-
N2H![]() +H2O
+H2O![]() N2H
N2H![]() +OH- N2H
+OH- N2H![]() + H2O
+ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO==_________NaCl+_______N2H4+_____ _____
(6)发射火箭时胼(N2+H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的转化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com